在血清中戴上“蛋白冠”,脂质体的跨膜方式由膜融合变为内吞 | NSR
以下文章来源于中国科学杂志社 ,作者《国家科学评论》
《中国科学》杂志社主要负责编辑出版发行《中国科学》系列和《科学通报》中英文版,共17种学术期刊,均由中国科学院和国家自然科学基金委员会共同主办,旨在见证中国科学发展,促进国际学术交流。
海归学者发起的公益学术平台
分享信息,整合资源
交流学术,偶尔风月

脂质体,特别是阳离子脂质体,是目前应用最广泛的药物/基因递送纳米载体。在血清环境中,脂质体会不可避免地吸附蛋白质等生物分子,形成“蛋白冠”结构。在最近发表于《国家科学评论》(National Science Review, NSR)的文章中,国家纳米科学中心梁兴杰研究团队发现,蛋白冠结构会影响纳米载体的界面性质,使脂质体跨越细胞膜的方式从非能量依赖的膜融合机制转变为能量依赖的内吞机制。
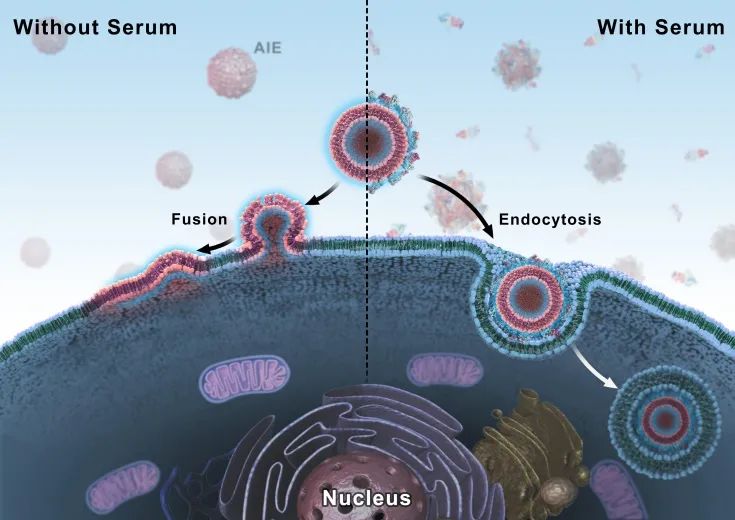 蛋白冠介导的阳离子脂质体与细胞膜相互作用
蛋白冠介导的阳离子脂质体与细胞膜相互作用首先,为了可视化示踪阳离子脂质体与细胞膜的相互作用,研究团队设计合成了一种正电性的脂质膜探针TR4分子(见下图)。TR4分子的结构包含几个部分:棕榈酸链使TR4分子可锚定在磷脂层中;四个精氨酸增加TR4分子水溶性,并将阴离子脂质体反转为阳离子脂质体TR4@Lipo(下图b);TPE分子具有聚集诱导发光特性,赋予阳离子脂质体自示踪特性。
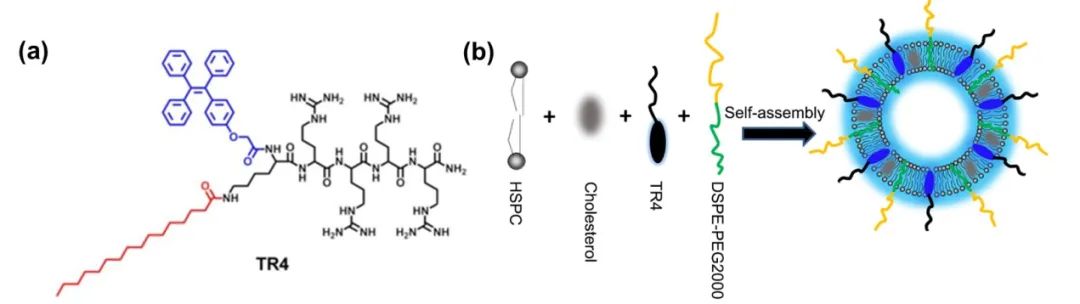 (a)TR4分子结构图;(b) TR4@Lipo阳离子脂质体的结构示意图。
(a)TR4分子结构图;(b) TR4@Lipo阳离子脂质体的结构示意图。
研究表明,在无血清条件下,TR4@Lipo通过非能量依赖的膜融合方式与细胞膜结合。但是,在人血清、胎牛血清或白蛋白等条件下,细胞主要通过能量依赖的内吞方式摄取TR4@Lipo(下图a)。研究者对胎牛血清浓度进行调节,发现膜融合过程转变为内吞过程的临界蛋白浓度在0.30%左右(下图b)。
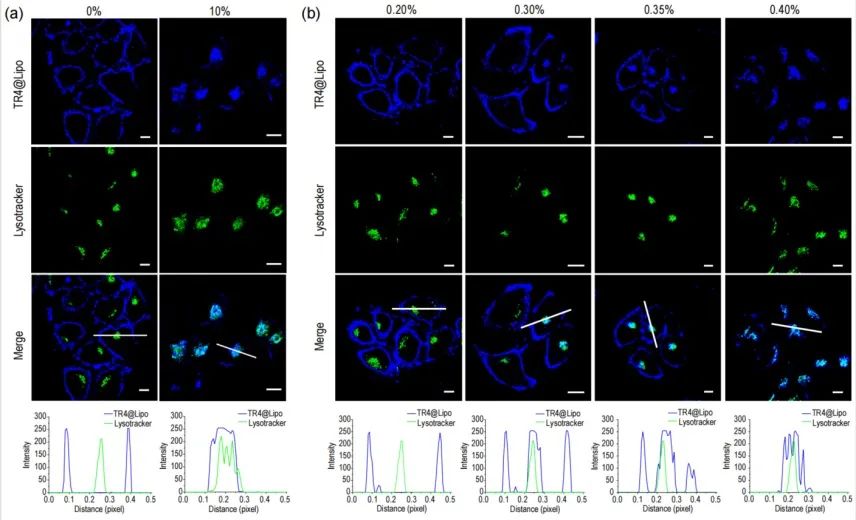
(a)无FBS条件下和10%FBS条件下TR4@Lipo和溶酶体共定位分析;(b)不同FBS浓度比例时TR4@Lipo和溶酶体共定位分析。
进一步研究表明,阳离子脂质体的蛋白冠结构还会影响其递送药物分子的亚细胞分布。在无血清条件下,脂质体递送的游离抗肿瘤药物阿霉素(DOX)主要分布于细胞核和溶酶体中,阴离子脂质体递送的DOX主要分布于溶酶体,而TR4@Lipo递送的DOX主要分布于细胞核;在血清条件下,TR4@Lipo递送的DOX主要分布于溶酶体(见下图)。
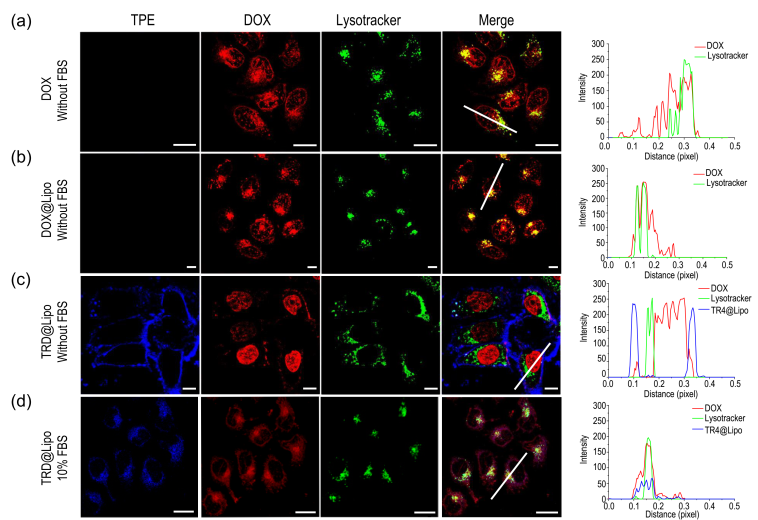
共聚焦显微镜分析不同条件下DOX和脂质体的亚细胞分布。(a)无FBS条件下游离DOX;(b)无FBS条件下正常的DOX@Lipo; (c) 无FBS条件下TRD@Lipo; (d)10% FBS条件下的TRD@Lipo。
该研究报道了蛋白冠对细胞转运阳离子纳米脂质体机制的调控,有助于深入理解复杂生理环境下纳米-生物界面的相互识别和作用机制。同时,该研究对阳离子脂质体的体外和临床应用等具有重要的参考意义。
该项工作得到了国家自然科学基金中爱(NSFC-SFI)国际合作项目、国家自然科学基金中德国际合作项目、国家自然科学基金面上项目、中科院战略性先导专项等项目的支持。
点击“阅读原文”查看论文原文。
扩展阅读
操控五重低能电荷态——在二维材料中调和“宽带隙”与“非局域电子态” | NSR
本文系网易新闻·网易号“各有态度”特色内容
媒体转载联系授权请看下方
