深度解析MIT张锋领衔开发的全新mRNA递送平台 | 专访国家纳米科学中心王海

“未来,SEND技术或将替代脂质纳米载体和病毒载体,成为最适合基因编辑疗法的载体,”8月21日,国家纳米科学中心研究员王海告诉DeepTech,他十分赞可CRISPR先驱张锋最新开发的mRNA递送平台。
日前,MIT博德研究所张锋教授团队,开发了一种名为SEND的新系统,该系统利用人类蛋白质来提供分子治疗。
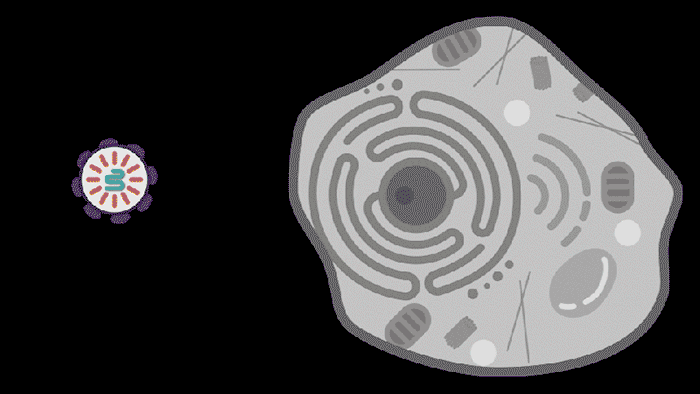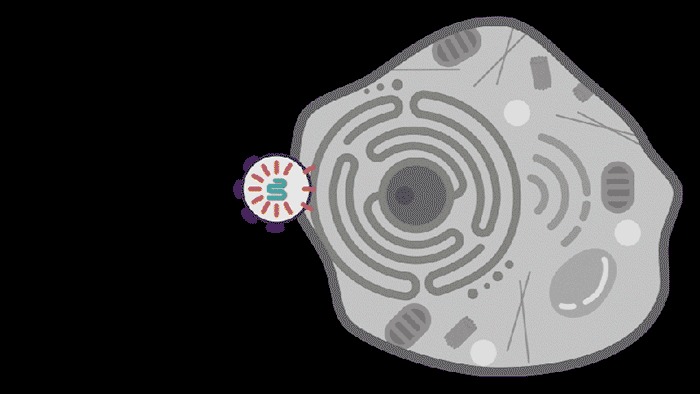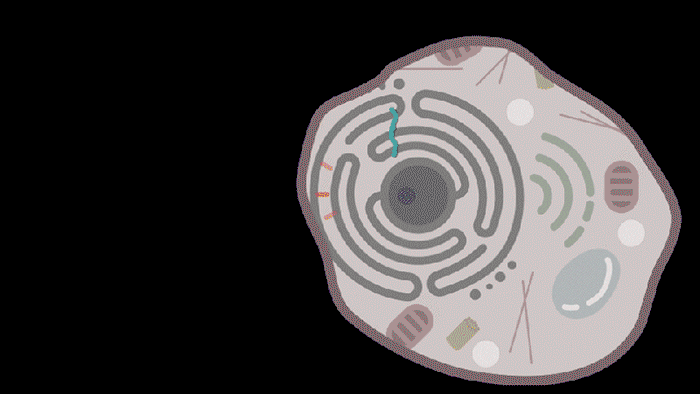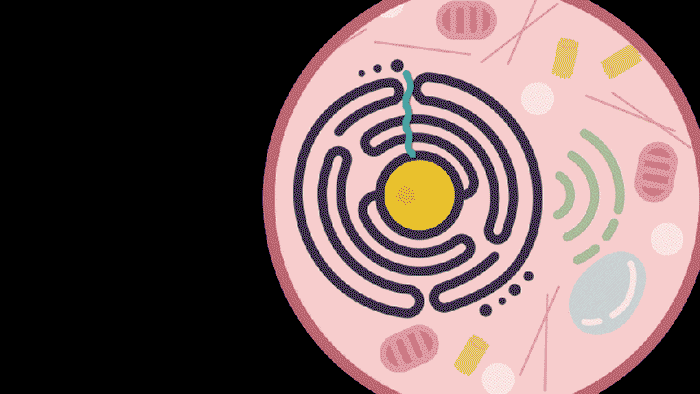
图 | 动图描绘了SEND技术为患病细胞恢复健康(来源:MITNews)
有观点认为“该成果打破了RNA的治疗困境”,对此国家纳米科学中心研究员王海告诉DeepTech:“我非常认同这一评价。由于RNA分子容易降解,在体内半衰期很短,过去一直被认为无法成为‘治疗药物’。直到针对新冠病毒的mRNA疫苗的出现,才让人们对RNA药物的开发重新燃起希望。目前使用的mRNA载体主要为病毒载体和脂质纳米载体—LNP,但病毒载体不利于持续给药,而LNP本身就具有一定的细胞毒性。”
“该成果开发出继病毒载体和LNP后第三种可靠的RNA载体,这一系统不会触发机体免疫反应,副作用大大降低。未来,SEND技术或将替代脂质纳米载体和病毒载体,成为最适合基因编辑疗法的载体,”王海表示。
8月20日,相关论文以《哺乳动物逆转录病毒样蛋白PEG10能包装其自身的mRNA并实现递送》(Mammalian retrovirus-like protein PEG10 packages its own mRNA and can be pseudotyped for mRNA delivery)为题,发表在Science上。

图 | 相关论文(来源:Science)
问题:RNA疗法仍面临很多挑战

王海告诉DeepTech,该研究要解决的痛点在于,药物的脱靶效应是全身给药的主要瓶颈,药物在非靶器官的高聚集、或者在靶器官的富集程度非常低,都有可能影响药物安全性和治疗效果,这也是造成药物研发失败的常见原因之一。此外,特定组织或特定细胞的靶向递送,面临着生物学屏障系统的挑战。
药物注射到血管内部后,会遇到进入组织后第一层生理屏障——血管内皮屏障,它仅能允许部分小分子药物从血液到达组织,但对于核酸、抗体等大分子药物,则很难透过这层屏障进入组织。在特定疾病状态下,血管内皮细胞会发生功能紊乱,从而导致血管内皮通透性发生改变,而这会增加药物进入组织的效率。
并且,在成功透过内皮层屏障后,药物需要穿过细胞外基质才能到达靶组织。小分子化合物可轻易穿过细胞外基质,而较大分子则会在细胞外基质中受到较大阻力。
而特定疾病状态可显著改变细胞外基质微环境,并形成新的生物学屏障。在到达靶组织后,靶向细胞内结构的治疗药物,需跨过细胞膜到达胞浆或核内靶标,只有这样才能发挥生物学效应。

图 | 国家纳米科学中心研究员王海(来源:受访者)
王海表示,疏水性小分子相对容易穿过细胞膜,而大分子及纳米颗粒则需要经过主动重摄取机制进入细胞,这一过程需要和细胞膜相互作用,并通过随后的细胞内吞机制进行。其中,内吞的大分子及纳米颗粒,可通过内涵体、吞噬体、溶酶体等细胞内囊泡结构进行转运。
因此,这些细胞内结构又成为药物分子进入胞浆的另一层生物学屏障。这意味着,对于核酸和多肽类药物的递送来说,它们本身稳定性差的问题也亟需克服。可以说,如何提高这些药物的稳定性,是药物递送面临的严峻挑战。
张锋也告诉媒体:“现有的分子疗法传递载体可能效率低下,并导致基因疗法随机整合到细胞基因组中,这两者都会增加副作用的风险。此外,有些会刺激不需要的免疫反应。”
因此开发出可安全递送RNA的递送系统,是该领域面临的最大挑战。RNA特别是裸露的RNA会被核酸酶降解,核酸酶会通过吞噬RNA在生理环境中的核酸而“茁壮成长”。所以,使用不激活人体免疫系统的方式来包装RNA,对于防止药物不良反应来说也很重要。
尽管在人眼范围内RNA非常小,但在分子生物学里RNA并不算小,因此通过细胞膜递送它可能会很麻烦。这就好比当你要邮寄一只玻璃杯,肯定会选择最靠谱的快递公司,对RNA来说同样如此。
办法:SEND打开一个新的传递路线

此次张锋团队联合提出的新型递送平台SEND,是一种选择性内源性的封装细胞传递,该团队相信SEND有潜力克服上述挑战。
他告诉媒体,在SEND系统内混合和匹配不同的组件,将为研发针对不同疾病的疗法打开一扇大门。SEND的技术原理在于利用人体细胞自身合成的PEG10蛋白,它能结合其自身的mRNA并在其周围形成一个球形保护胶囊。
此次研究中,该团队设计了PEG10以选择性地包装和递送其他RNA,并使用SEND将CRISPR-Cas9基因编辑系统传递给小鼠和人类细胞以编辑目标基因。这表明,人体中可能还有其他RNA转移系统也可用于治疗目的。
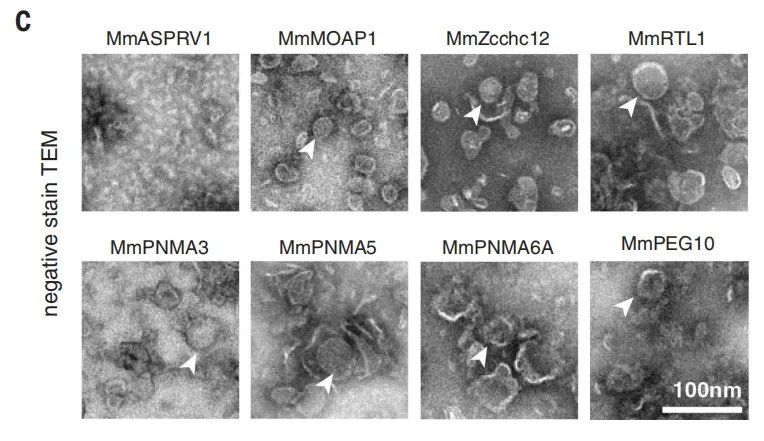
(来源:Science)
要了解SEND的工作原理,先得弄懂一种上述名为PEG10的蛋白质,它是逆转录转座子衍生蛋白质的其中一种。转座子是一段能“移动”的DNA片段,它通过“复制和粘贴”机制来实现在基因组中的移动。
而逆转录转座子则是将DNA序列转录为RNA后,再通过RNA转移到基因组上的目标位点,并通过逆转录酶逆转录为DNA序列,从而实现在基因组中的移动。
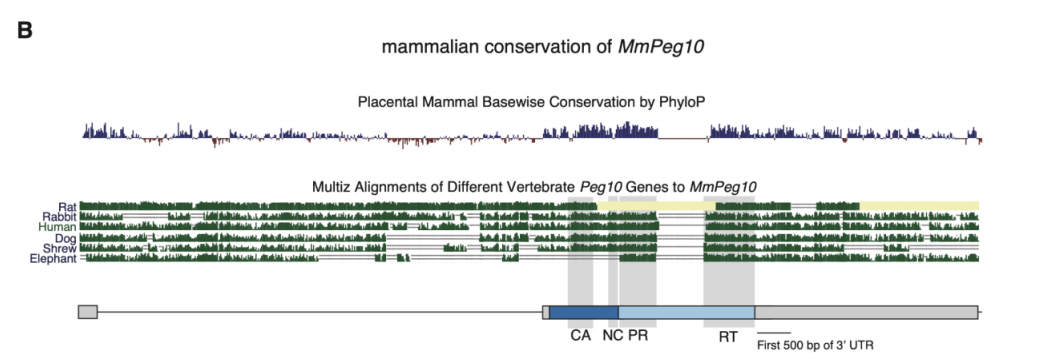
(来源:Science)
此前有研究表明,另一种名叫ARC的逆转录转座子衍生的蛋白质,可形成类似于病毒的结构,并能够在细胞之间转移RNA。因此,是否有可能将逆转录转座子蛋白设计为遗传物质的“信使”?
之前曾有学者有过这种设想,但尚未得到证实。而张峰团队在人类基因组中,鉴定了许多种逆转录转座子衍生的蛋白质,其中就包括PEG10。
它的衣壳内主要包含其自身的mRNA,这说明它有一个特定的机制去指导包装过程。因为,研究人员希望利用它来重新编程PEG10包装。
效果:SEND在人类细胞和小鼠细胞中均测试成功

这项成果涉及多个步骤,首先研究人员在PEG10的mRNA中找到了PEG10蛋白识别和包装的关键分子序列。然后,研究人员通过改造PEG10蛋白来实现其对其他RNA的识别和包装作用。
最后,他们在PEG10胶囊的表面进行一定的靶向修饰,以实现组织或细胞的靶向性。为了测试SEND技术是否可行,该团队采取用PEG10递送一段编码荧光蛋白的信使RNA。他们发现细胞可以开始发出荧光,因此这种策略是可行的。
接下来,他们用PEG10蛋白实现了对Cas9 mRNA以及sgRNA进的包装。通过SEND技术,他们发现,人类细胞和小鼠细胞基因组的目标位点均成功实现了基因编辑。
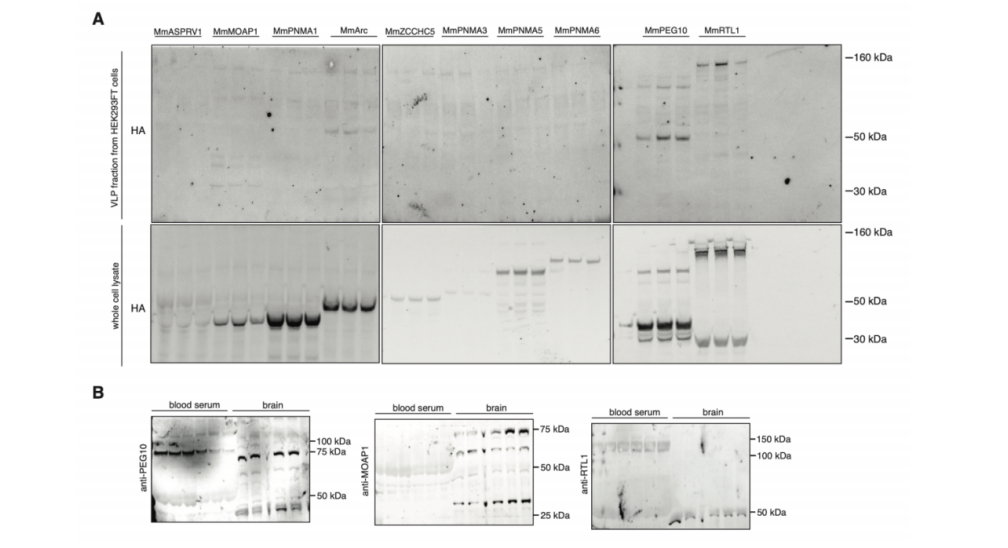
(来源:Science)
概括来说,此次成果表明,通过改造PEG10蛋白的RNA包装组件和识别组件,理论上能针对不同疾病提供模块化的治疗平台。谈及可带来的好处,王海告诉DeepTech,现有的病毒载体一般只能注射一次,不能持续给药,因为病毒会引起人体的免疫反应,还会加速药物的清除速度,甚至产生严重的不良免疫反应,这给当前的分子疗法有非常大的局限性。
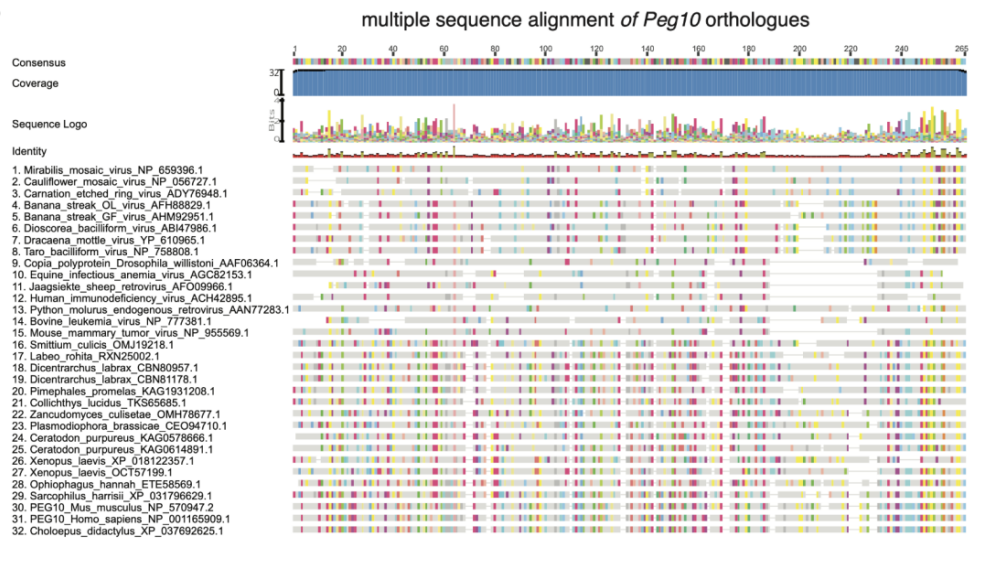
(来源:Science)
而通过此次方法,有望减少人体对mRNA运输载体的免疫反应,让以蛋白为载体进行常规的mRNA靶向运输成为可能。
王海总结称,这或将推动分子疗法进入下一个快速发展的阶段,此外这种模块化的平台还能降低成本,有利于推动分子疗法的产业化。目前,该研究仍处于早期阶段,但张锋等人对这一初步结果感到十分鼓舞。
接下来,研究人员还得了解SEND系统在体内的工作情况,并进一步优化该系统,以便将RNA运送到各种组织和细胞。未来,他们还将继续探索SEND系统在人体中的自然多样性,来确定其他组件是否也能被添加到SEND中。
-End-
专业审核:Bao

