【凯泰行研】糖尿病再生治疗行业研究

凯泰资本行业研究报告
——糖尿病再生治疗行业研究
作者:生物医药与生命科学团队
【前言】
随着新一代技术的进步,许多疾病的治疗将有望迎来治愈或功能性治愈时代。再生医学近年来有巨大的进展,我们认为再生医学将为糖尿病领域的治疗带来深刻的变革。由于糖尿病巨大的患病人群,也将给社会带来巨大的影响。
国外在糖尿病再生领域已有多年基础,目前整体也处于早期。我国在相关基础科研上有领先优势,也在迅速推进产业化,或许可以为全球的糖尿病病人做出贡献。
本篇行业研究《糖尿病再生治疗行业研究》由凯泰资本副总裁王亚楠完成,欢迎大家指正和交流。
投资建议
目前糖尿病的治疗取得了很大的进步,但是血糖波动带来的并发症仍然高发,是糖尿病的最大未被满足需求。糖尿病的治疗目标为功能性治愈——稳定控制血糖;
从已有的临床证据来看,胰岛移植能够实现糖尿病功能性治愈;
临床上通过再生医学手段治疗I型糖尿病已有了初步验证;
胰岛分化技术壁垒非常高,建议关注具有底层创新技术标的。
行业研究报告
一、糖尿病概述
1.1 定义及流行病学
糖尿病是一类由胰岛素分泌功能缺陷或/和胰岛素作用缺陷引起的、以慢性血糖升高、代谢异常和“继发性特征性系统损害”为特征的慢性疾病。I型糖尿病是由于胰岛β细胞受到免疫系统攻击,而II型糖尿病是一种代谢疾病,由不良生活方式引起胰岛素抵抗。全球约有4.63亿人患有糖尿病,约5-10%为I型糖尿病,约90%-95%为II型糖尿病。[2]
中国约有1.16亿糖尿病患者。在美国约2690万人患有糖尿病,约占全部人口的8.2%,另外还有约8800万成人患有前驱糖尿病,占全部成人人口的34.5%。美国糖尿病协会(ADA)统计,2017年美国在糖尿病上的花费约为3270亿美元,是医疗负担最重的疾病。
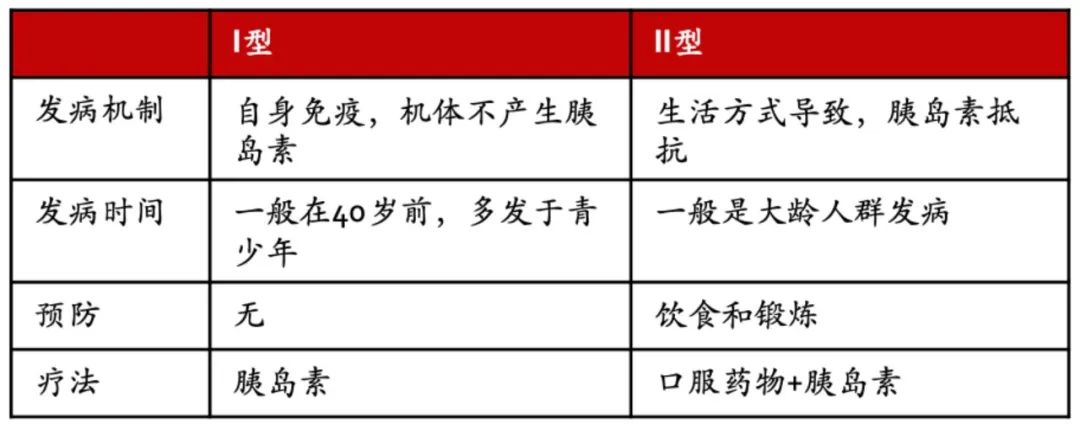
图 | I型糖尿病和II型糖尿病特征
由于现代人不良的生活习惯,糖尿病整体发病率呈较快速上升状态。
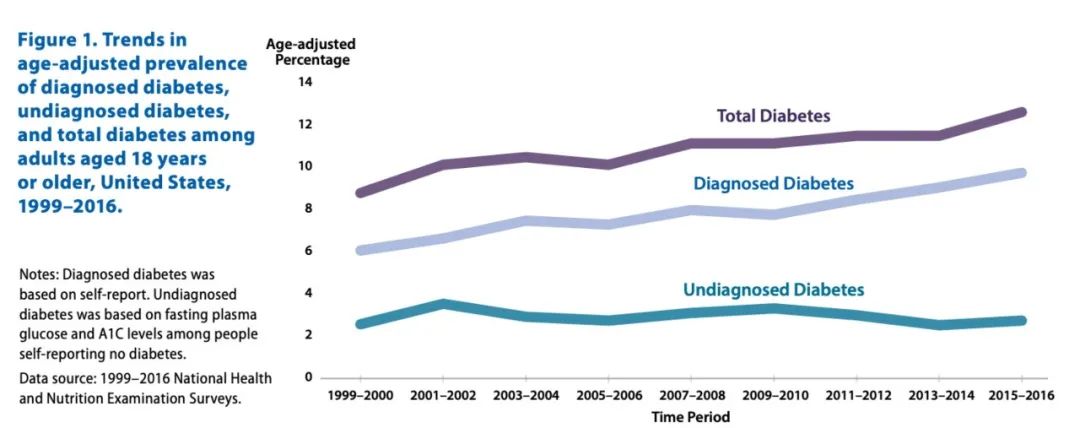
图 | 糖尿病发病人数增长趋势
source:CDC. National Diabetes Statistics Report, 2020
1.2 糖尿病未被满足需求
糖尿病领域的药物非常多,包括各种长效和短效胰岛素,以及各种类型的胰岛素泵,以及GLP-1类、SGLT-2类等。但即使有这么多药物的情况下,糖尿病的治疗仍然有巨大的完善空间。
众所周知,糖尿病最显著的特征是高血糖,但是高血糖短期内既不致命也不致残,真正影响糖尿病患者的是血糖波动带来的各种并发症。
糖尿病导致的并发症有100多种,是糖尿病病人致死致残的主要原因,主要包括:
a. 大血管病变
心脑血管疾病病变,是导致糖尿病病人死亡的重要原因,包括冠心病、急性心肌梗死、高血压、高血脂等;
b. 小血管病变
肾病、视网膜病变、糖尿病足、神经病变等;
c. 急性病变
糖尿病酮酸症等;
d. 低血糖
低血糖也是糖尿病人死亡的重要原因。
在美国,2016年约有782万糖尿病患者因并发症而住院,占全部患者的34%。
约37%的糖尿病患者患有肾病,终末期肾病病人约有28.8万,每年新发病率约为5.8万,约占所有终末期肾病的38%,眼部疾病发病率约为11.7%[1]。
糖尿病并发症的发病机制,溯其根本,还是因为血糖的波动。血糖过低会直接导致患者昏厥甚至死亡;而当血糖过高时,患者全身上下的组织和细胞都“浸泡”在高糖环境下。长期处于高血糖环境下会引起蛋白质不可逆的非酶糖化、细胞氧化还原电位改变、氧化应激和炎症反应增加、内皮功能障碍和高凝状态。血管受到高血糖的影响更大,因此糖尿病并发症主要由各种大血管病变和小血管病变组成。
血糖水平越高,患病时间越久,并发症的发病率越高。
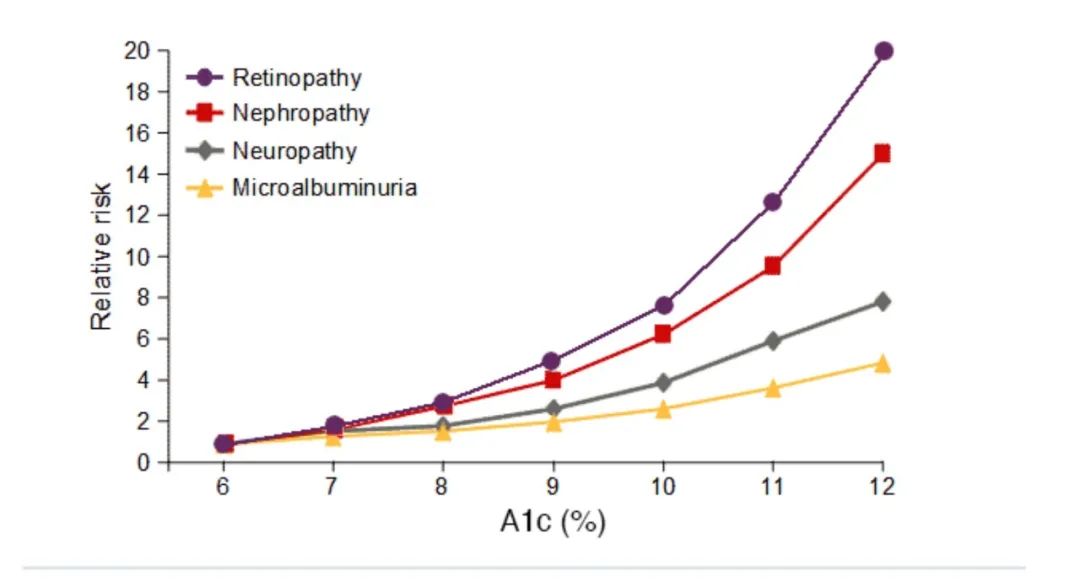
图 | A1C(%)和并发症的关系
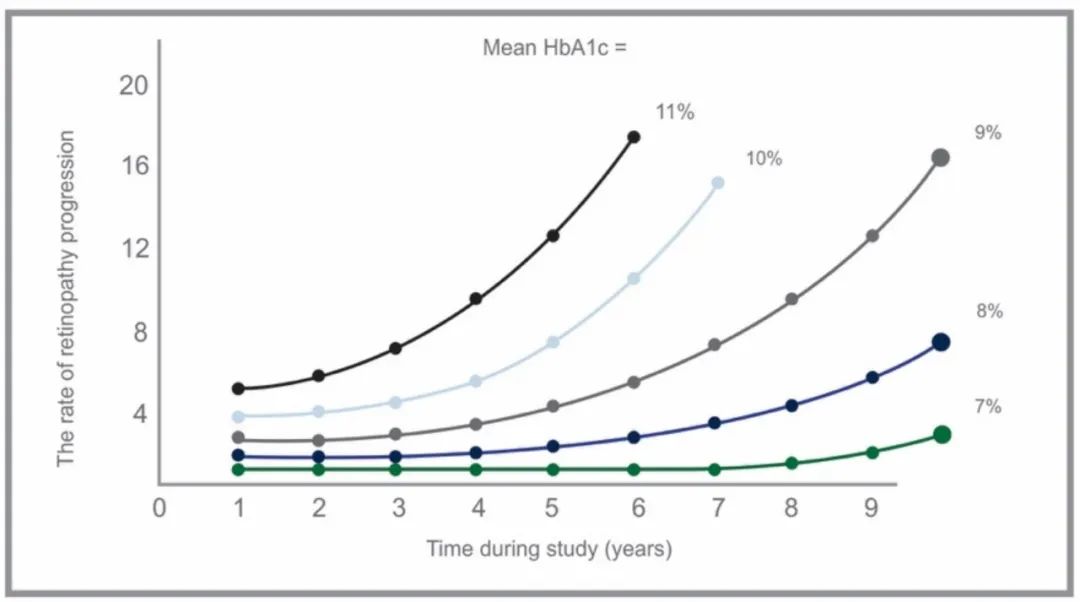
图 | 不同A1C(%)和视网膜病变的关系
source:Diabetes. 1995 Aug;44(8):968-83
1.3 目标范围内时间(TIR)
糖化血糖蛋白是长久以来一直使用的重要指标,CGM技术的发展,使得医生能够更准确地测量患者的血糖波动,time in range指标也开始用的越来越多。
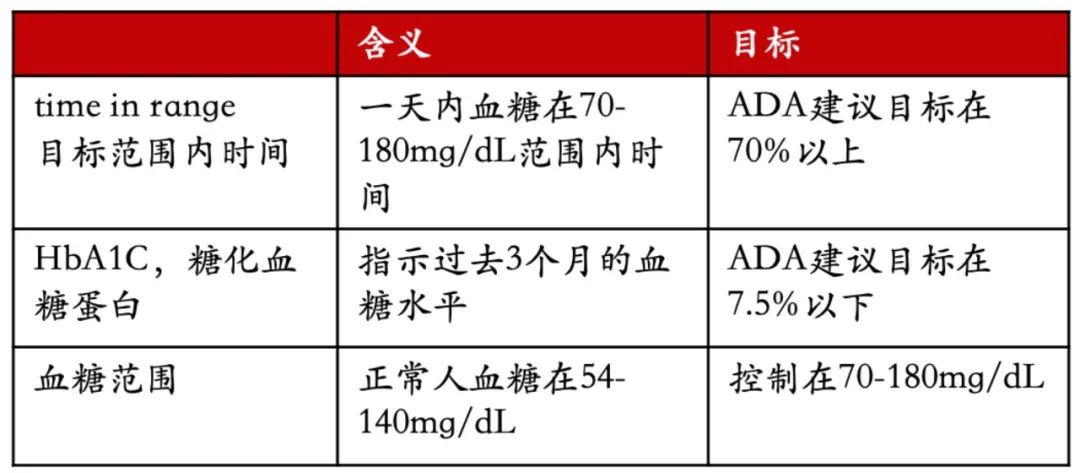
图 | 糖尿病相关指标
TIR的时间越长,越不容易引发并发症。TIR每提高5%,会给病人带来显著的临床获益。
TIR和糖化血糖蛋白有直接的关联,TIR提供更及时的血糖变化。
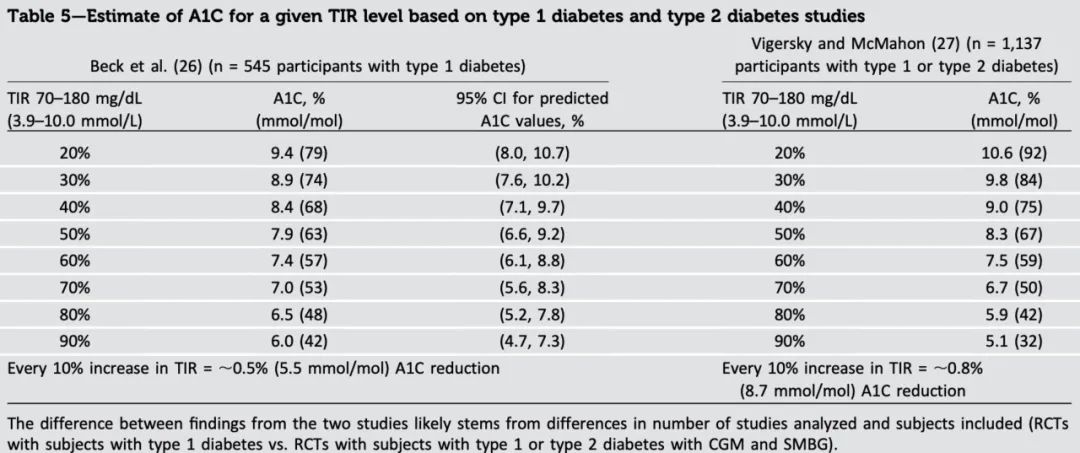
图 | A1C和TIR的关系
source:Diabetes Care 2019;42:1593–1603
对TIR的国际共识中,对于TIR提出了目标控制范围,对于一般的糖尿病患者来说TIR超过70%,对于高风险或大龄糖尿病患者TIR要超过50%。
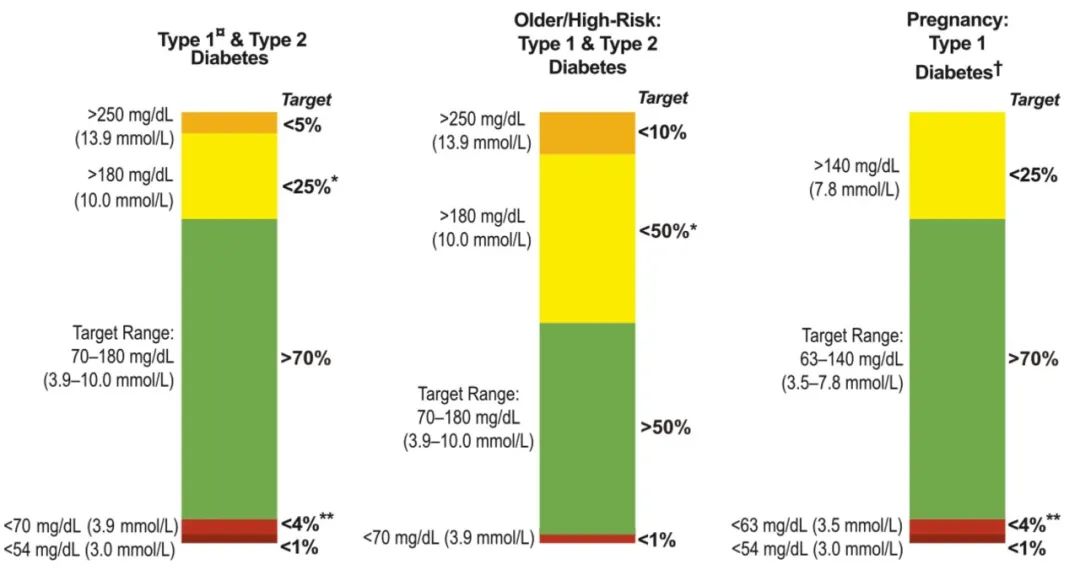
图 | 共识对于TIR的目标要求
source:Diabetes Care 2019;42:1593–1603
虽然共识对于糖尿病的TIR的控制目标在70%以上,但是并不是说达到了这个目标就不会发生并发症。在一项对超过3200名糖尿病患者的统计中,当TIR>86%时,严重的视网膜病变发生几率仍有3.5%。而当TIR低于51%时,严重视网膜病变发生几率有9.7%。
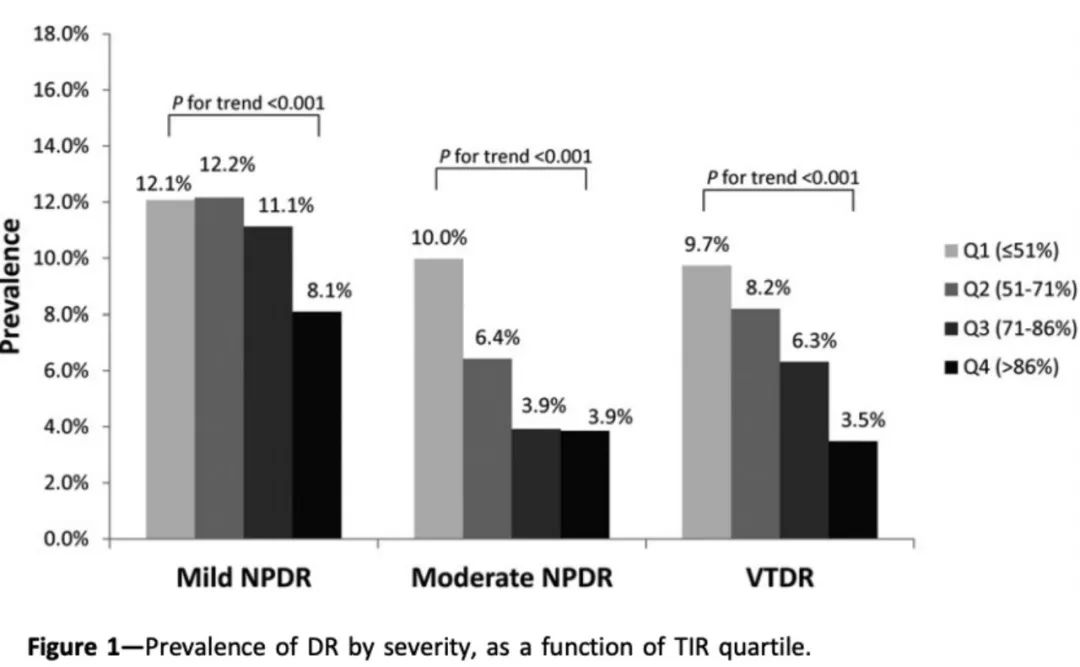
source:Diabetes Care 2018;41:2370–2376
目前并不清楚TIR具体要达到多少才能不发生并发症,但是由于TIR的测量范围是70-180mg/dL,同时健康人的血糖范围一般在54-140mg/dL,所以糖尿病人的TIR应尽可能接近100%才能尽可能地减少并发症,对应的HbA1C大约需要达到5.7%以下。
指南和共识对于TIR要求的“低标准”其实反映出一个巨大的问题,就是当前的治疗手段无法达到令人满意的治疗疗效。
二、糖尿病当前治疗
2.1 胰岛素泵
I型糖尿病的治疗中,目前疗效最好的是闭环胰岛素泵,以美敦力的MiniMed系列为代表。
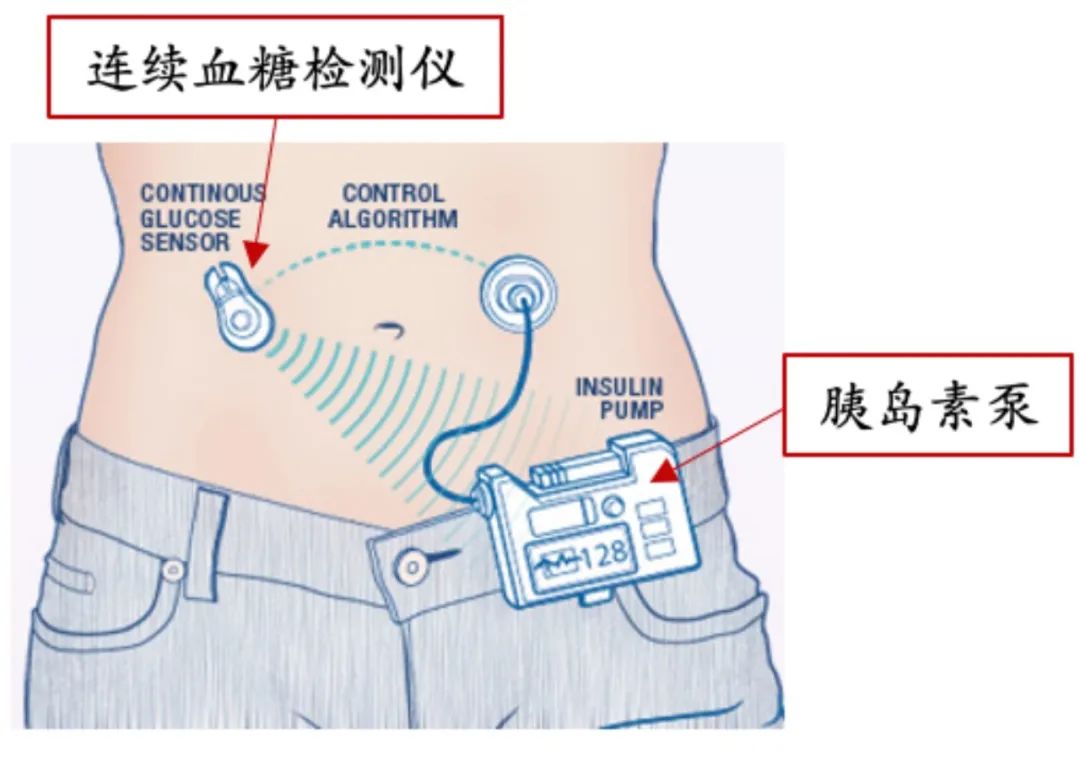
2021年6月,美敦力公布了最新产品MiniMed 780G的真实世界临床疗效,在4120名I型糖尿病人中,MiniMed 780G实现的TIR达到76.3%。但76.3%的TIR远远不能杜绝并发症的发生发展。
2.2 GLP-1类似物
在II型糖尿病的治疗中,GLP-1类似物的疗效比较出色,以索马鲁肽为代表。索马鲁肽在平均患病年龄14年的3297名II型糖尿病中,在2个月的时候将HbA1C降低到7%以下,而后缓慢上升。
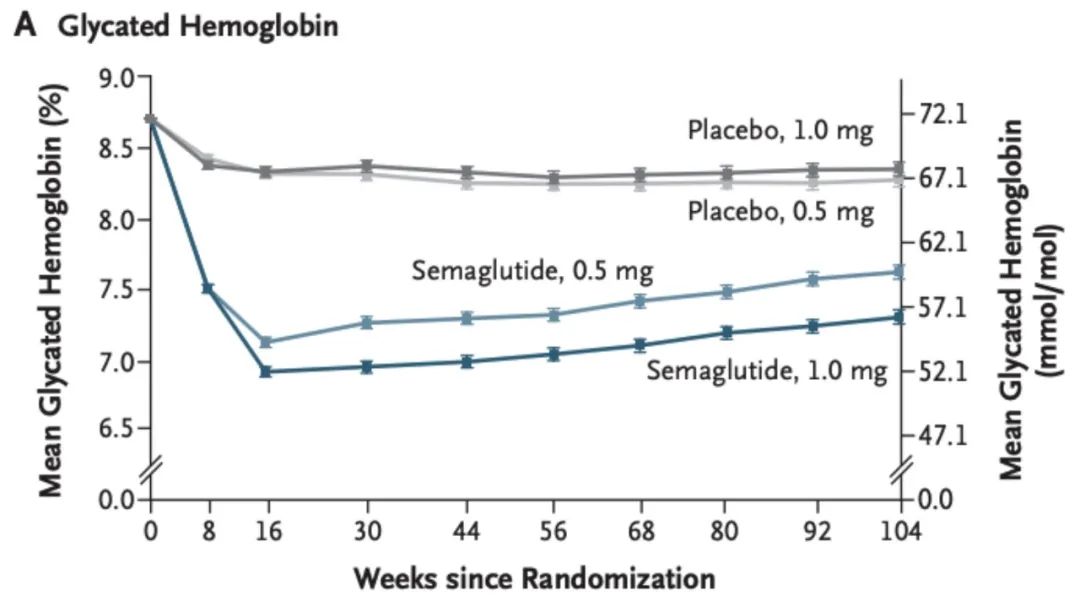
图 | 索马鲁肽治疗II型糖尿病的效果
source:N Engl J Med 2016;375:1834-44
II型糖尿病的治疗情况和患者本身的胰岛功能相关,有研究称,II型糖尿病在诊断时已丧失50%的胰岛功能,并且胰岛会随着疾病进展而逐渐耗竭。
2.3 器官移植——胰腺整体移植和胰岛移植
在糖尿病的治疗中还有一种相对小众的治疗方法——器官移植。
一般非常严重的糖尿病病人会选择进行器官移植,分为胰腺整体移植和胰岛移植。
从1966年到2015年,共有21328例胰腺整体移植病例。术后45%的病人能够实现5年胰岛素独立。随着手术技术的进步,病人生存率和胰腺功能存活率也在不断提升。截至2008年,90%的移植胰腺能达到5年生存,大约70-80%的病人能实现5年胰岛素独立。[6]
移植之后的效果是非常优异的,2011年的一项临床显示移植胰腺之后,空腹血糖、糖化血糖蛋白和c-peptide能在4年时间内保持正常。并且移植之后,蛋白尿显著改善,肾功能下降减缓,心血管、视网膜等病变改善。
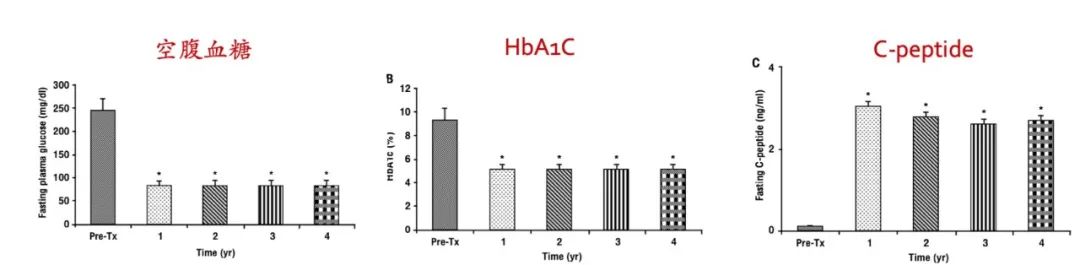
图 | 胰腺移植后的疗效
source:Rev Diabet Stud (2011) 8:259-267
胰腺移植效果很好,但始终是个大手术,手术存在一定风险,只有非常严重的糖尿病患者能够获得临床获益。
2000年Edmonton方案的提出为胰岛移植带来革命性的突破,现在每个患者只需要从门静脉输入50万IEQ(islet equivalent)当量胰岛(正常人体内有100万IEQ当量胰岛)即可获得长期的治疗效果 。目前全球已有数千例胰岛移植经验。
从供体胰腺中分离胰岛细胞,经皮肤输注到门静脉,将胰岛细胞移植到肝窦,手术简单,半小时内可以完成。
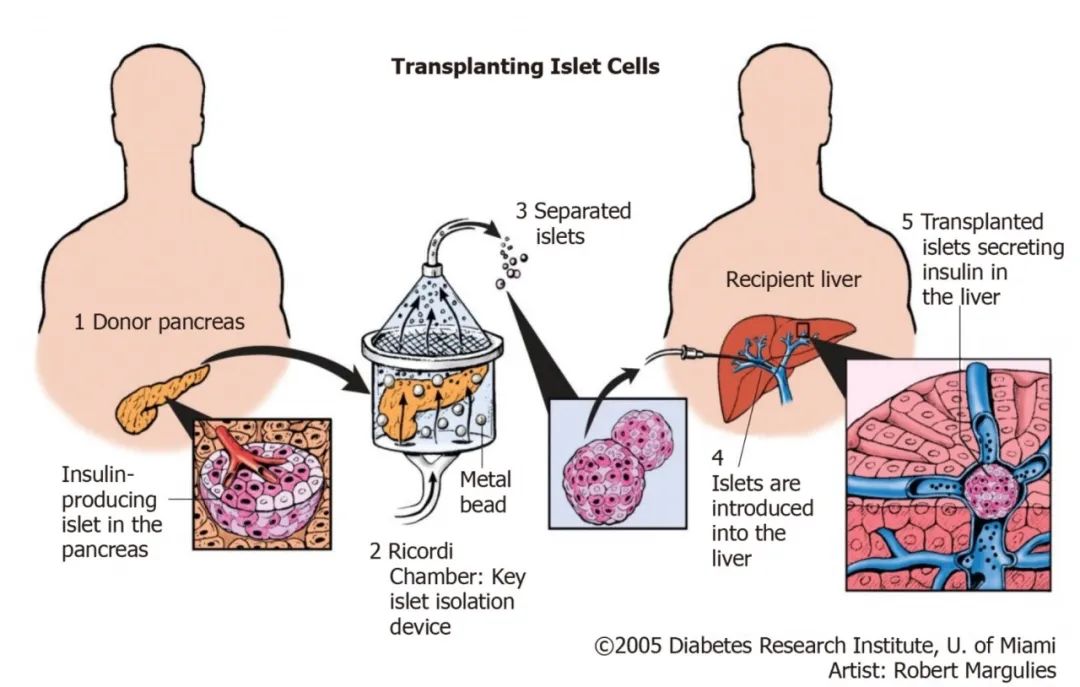
图 | 胰岛移植流程
和胰岛素泵相比,胰岛移植能达到的疗效是惊人的,相当一部分胰岛移植能够将血糖的波动基本控制在健康人的血糖范围内(54-140mg/dL)。
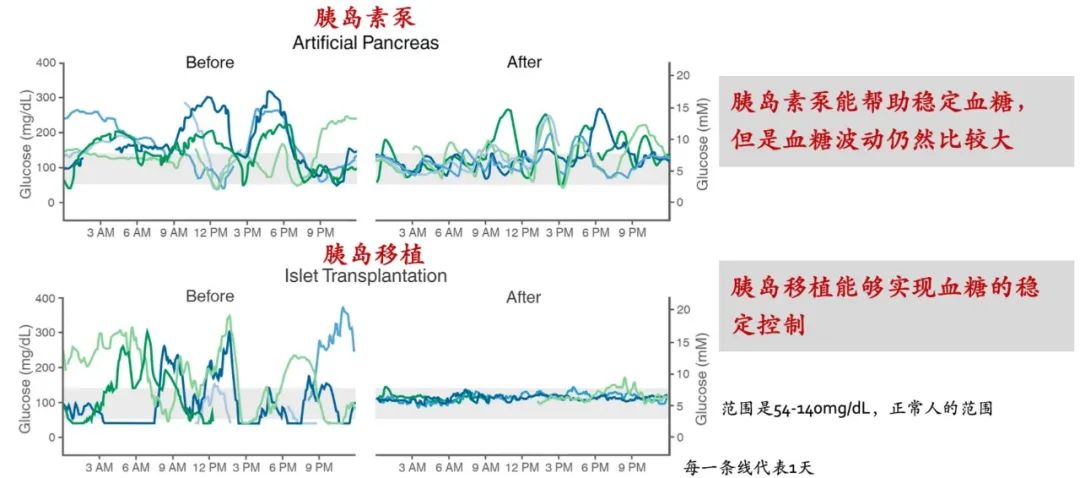
图 | 胰岛移植对比胰岛素泵疗效
source:Cell Metabolism 29, March 5, 2019
和胰岛素泵相比,胰岛移植从机制上来说也有更多的优势。
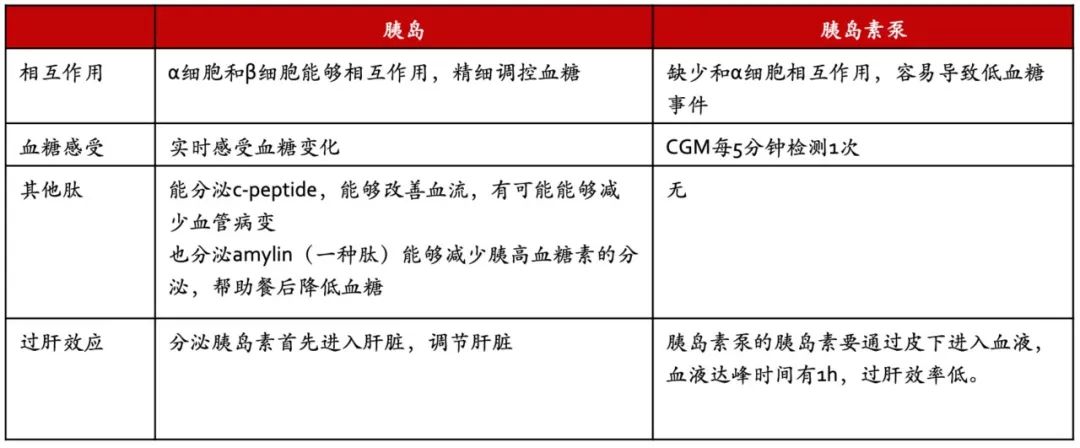
图 | 胰岛对比胰岛素泵作用机制
逐渐也有胰岛素泵开始尝试同时给胰岛素和胰高血糖素,总体方向是变得更像胰岛,不过现在看来,胰岛素泵要达到胰岛的功能还有很长的一段路要走。
当血糖控制在正常范围内,糖尿病患者不会出现高血糖带来的组织病变和可能危及生命的低血糖,患者也无需使用胰岛素,生活质量将和非糖尿病人相当。
如果胰岛移植能达到这样的疗效,那么就引入另外一个概念——“糖尿病的功能性治愈”。
目前对于糖尿病的功能性治愈还没有统一的定义,主要是在不使用或使用极少外源胰岛素的情况下,实现血糖在正常范围的稳定控制。
和比较火爆的“乙肝功能性治愈”相比,糖尿病的功能性治愈的临床意义可能更大。
胰岛来源
胰岛移植也面临2个重要的问题,供体受限及免疫抑制剂的使用。
根据Organ Procurement and Transplantation Network,2017年接受1315个供体,平均2个donor可以满足1个病人。供体胰岛容易损毁或者不合格,并且分离困难。胰岛移植本质上是一种器官移植,所有器官移植面临最大的问题就是短缺问题。
现在主要有3种可能的胰岛来源,供体捐献、猪胰岛和干细胞分化来源。
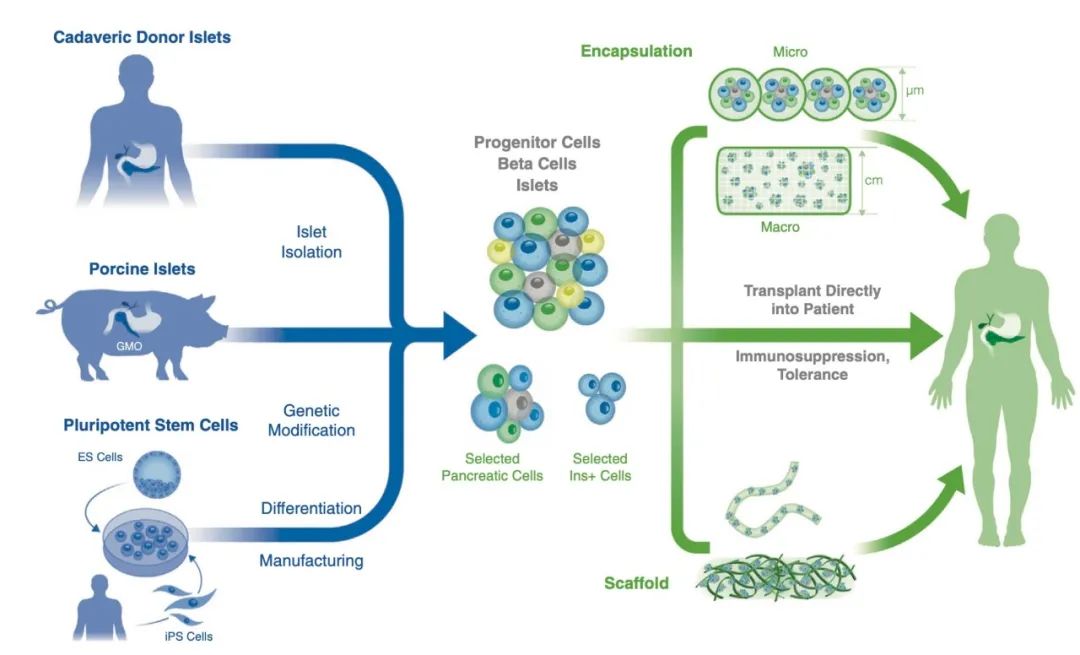
图 | 胰岛的不同来源
这3种胰岛面临不同的问题:
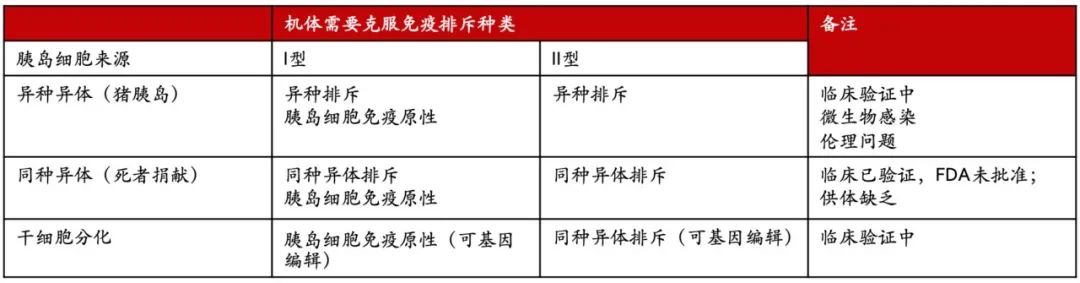
对于猪来源的器官,前不久美国有团队使用基因编辑的猪肾脏在一脑死亡的患者上进行3天的体外试验,没有发现免疫排斥,这是一个可喜的进展。但对于这个进展的意义,现在还在争论中,毕竟免疫排斥最重要的是要看长期免疫排斥。现在来看,异种排斥可能还会是一个巨大的阻碍。
对于猪胰岛移植来说,即使最终克服了异种排斥,胰岛的分离也是比较困难的事情。
三、糖尿病未来疗法-再生胰岛
3.1 关于Viacyte
使用再生医学的方法生产胰岛是较为可行的途径,目前全球有不少公司在这个领域尝试,其中有些公司已经获得了不错的进展。
领域的先行者是Viacyte,公司前身于1999年成立,公司开发出胚胎干细胞稳定分化成胰岛前体细胞技术,植入皮下后,需要继续分化成胰岛细胞,过程需要几个月的时间。

2014年使用完全封闭包囊的VC-01首次进入临床,入组了19个I型糖尿病病人,每个病人植入2个大的unit和4-6个小的可拆卸的unit,血管无法进入。
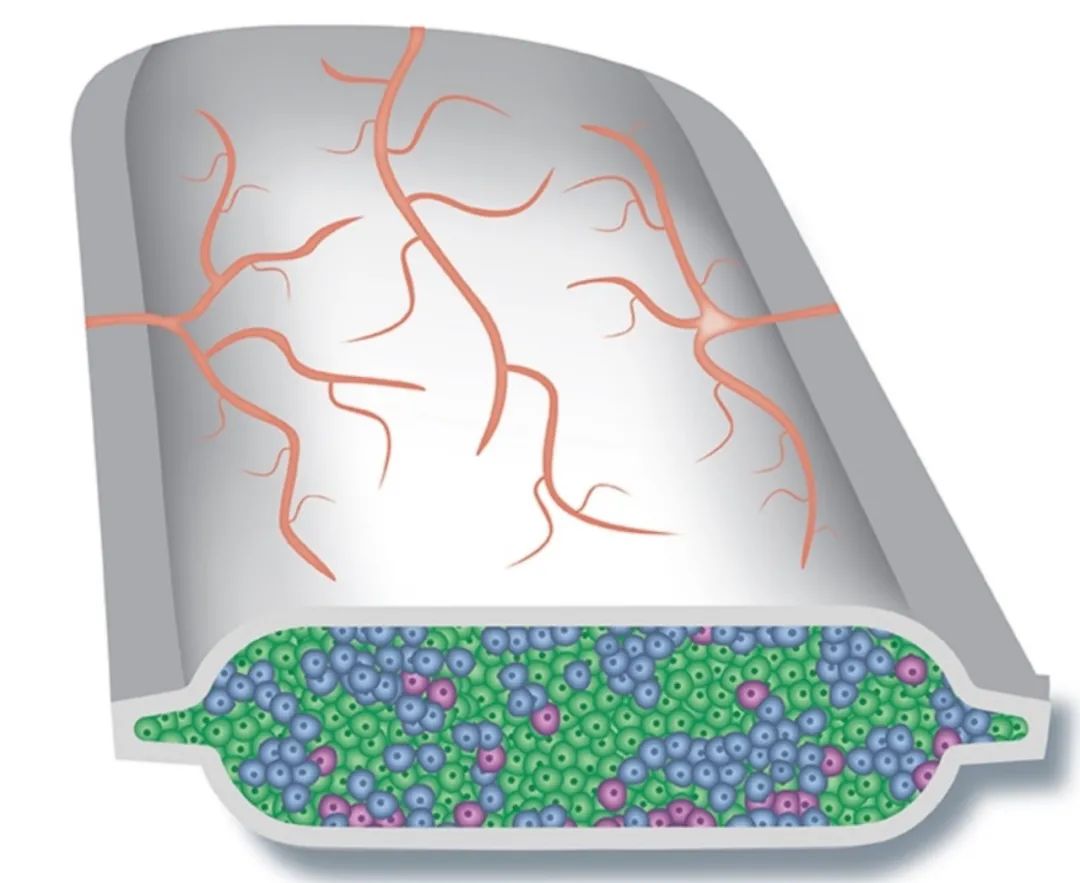
图 | 封闭式包囊产品VC-01
最后临床结果却让人失望,大部分病人移植12周后,移植细胞大部分死亡,大概是因为胰岛细胞是高耗氧细胞,需要大量能量和氧气,VC-01产品血管无法进入,导致缺氧;同时包囊表面也有免疫反应。Viacyte是领域先行者,首次封闭包囊临床试验失败,对行业是个不小的打击。[7]
Viacyte反思了策略,使用新的开放包囊包裹胰岛细胞,允许血管进入,同时使用免疫抑制剂。在2021年6月份,Viacyte公布了第一个开放包囊的临床结果。
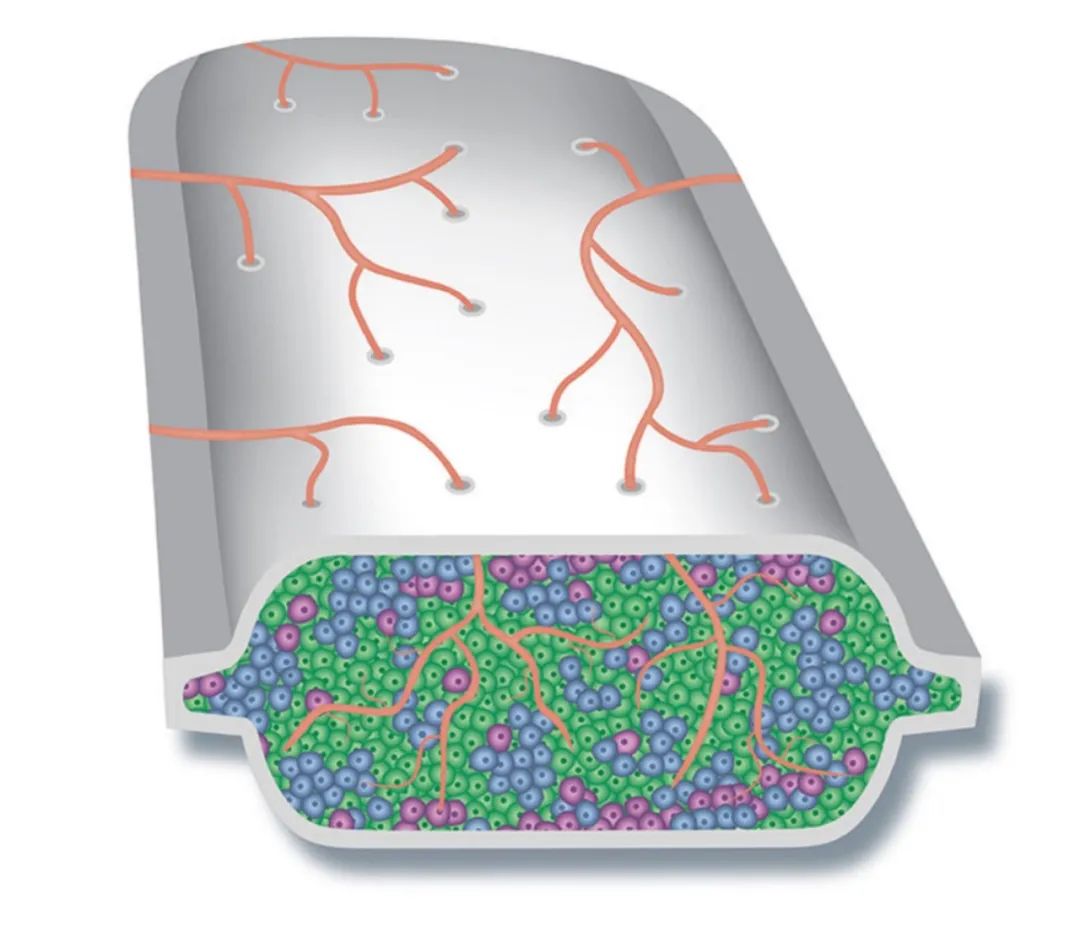
图 | 开放式包囊产品VC-01
第一个病人是一个严重的I型脆性糖尿病病人(血糖波动非常大),给药前TIR只有56%,血糖每天只有约一半时间在正常范围,到用药第10个月的时候TIR达到了88%,c-peptide也达到了正常的范围内。
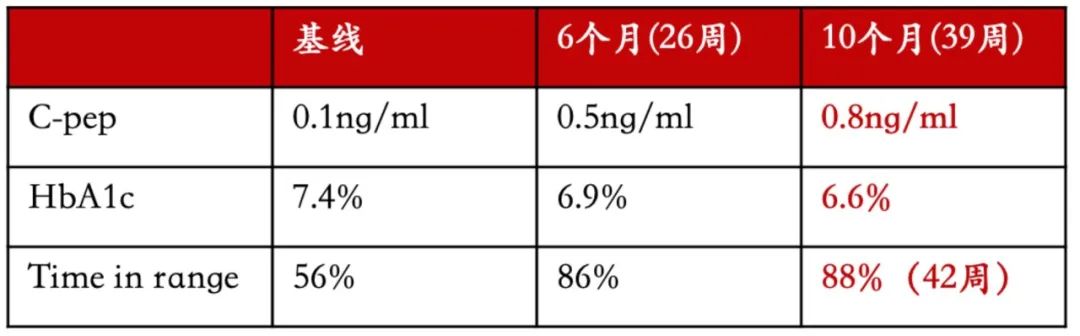
图 | VC-02的临床疗效
source:https://viacyte.com/press-releases/viacyte-reports-compelling-preliminary-clinical-data-from-islet-cell-replacement-therapy-for-patients-with-type-1-diabetes/
这是一个非常重要的进展,也是首次干细胞分化的胰岛细胞在人体内取得阳性数据,但Viacyte的这个方法仍然存在问题:
• 移植到皮下,分泌胰岛素达到血管有延迟,在肝脏暴露少,理论效果不如移植到肝内,肝脏是调节血糖的重要器官;
• 包囊的血管化时间更长,胰岛前体细胞分化成成熟胰岛也需要时间,导致起效时间慢。
一般来说死者捐献胰岛移植到肝脏,在一个月的时候就可以非常有效地控制血糖波动并脱离胰岛素,Viacyte在第10个月的时候才达到了88%的TIR,并且没有公布胰岛素的用量变化。
3.2 关于Vertex
另外一个行业先行者是Semma Therapeutics,创始人是著名的干细胞学者Douglas Melton。Semma 成立于2015年,2019年Vertex以9.5亿美元的价格收购Semma,当时Semma在动物实验中完成验证。当初Semma也是准备做包囊化的产品,不过包囊的策略确实存在不小的挑战,后续率先上临床的产品是不使用包囊的裸细胞。
Vertex首个产品VX880在2021年3月进入临床I期,使用胚胎干细胞分化得到,通过肝门静脉输注,移植到肝内,用于高风险I型糖尿病病人,同时使用免疫抑制剂。和Viacyte的胰岛前体细胞不同,Vertex声称VX880为分化较成熟的胰岛β细胞,不过实际上可能也包括α细胞。
2021年10月份,Vertex公布了第一例患者出色的治疗效果,这名患者患有较为严重的I型糖尿病,一年内有多次严重低血糖事件发生。给药90天后,患者的糖化血糖蛋白从8.6%降到了7.2%(糖化血糖蛋白反应过去3个月的血糖水平),胰岛素用量从34个单位降到了2.9单位,C-peptide进入正常范围。Vertex没有公布病人的TIR,从这些结果来看,TIR应该有大幅改善。[8] 这种治疗效果已经接近功能性治愈。
除此之外,诺和诺德、礼来、Sana等公司也在研发干细胞分化来源的胰岛细胞,Sana直接对胰岛β细胞进行基因修饰,开发免疫豁免型的产品。
3.3 关于智新浩正
中国也有相关公司在开发类似产品,比如智新浩正。智新浩正使用与国外不同的技术路线,使用分化潜能更低,更接近胰岛的内胚层干细胞作为种子细胞。
内胚层干细胞路线主要基于程新博士2012年的一篇文章。

全能胚胎细胞能够分化成人体所有类型细胞,在分化过程中,会逐渐分化成潜能稍低的多能细胞。中胚层多能细胞、内胚层多能细胞和外胚层多能细胞能够分化成各自胚层的相关组织或细胞。
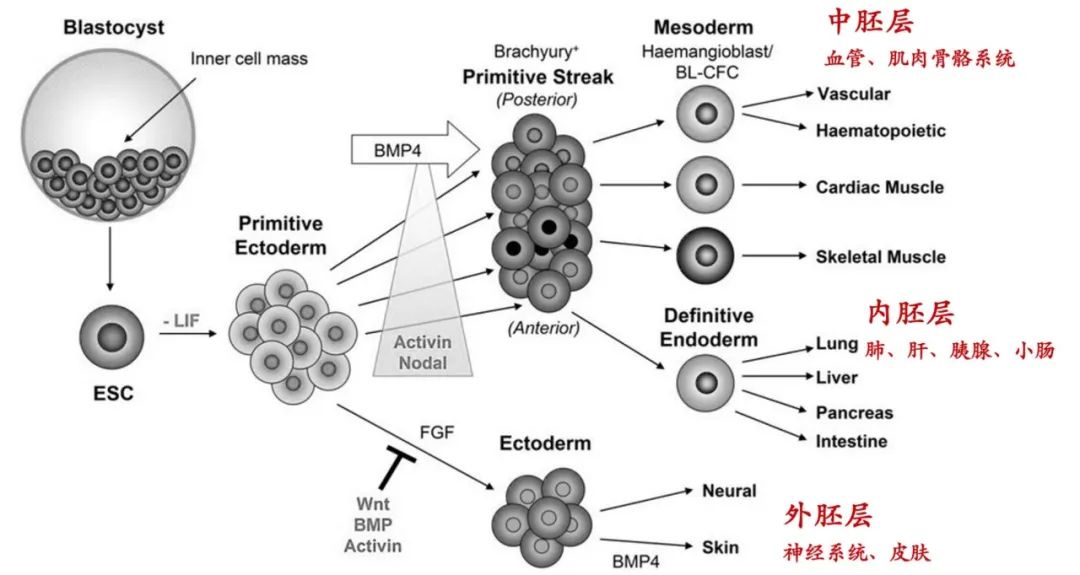
图 | 中胚层、内胚层和外胚层
内胚层干细胞相比较全能的IPSC而言,能更加高效地分化成胰岛细胞。同时,内胚层的成瘤潜力非常低,在动物实验上没有出现过成瘤事件。
基因和细胞领域是近年来的新兴领域,也取得了非常大的进展,不过从近一两年来看,部分疗法可能存在被低估的安全性风险。因为临床上出现的潜在安全性事件,FDA暂停了多个基因和细胞领域的临床试验。尤其是对于糖尿病这类非致命性疾病,出现肿瘤是非常严重的事件。
智新浩正从内胚层干细胞出发,能够分化出和天然胰岛相似的胰岛结构,包括α、β和δ细胞。
在全球再生领域里,大部分公司通过分化出单类细胞发挥治疗作用。截至目前,智新浩正是为数不多能够分化出组织发挥治疗作用的公司。
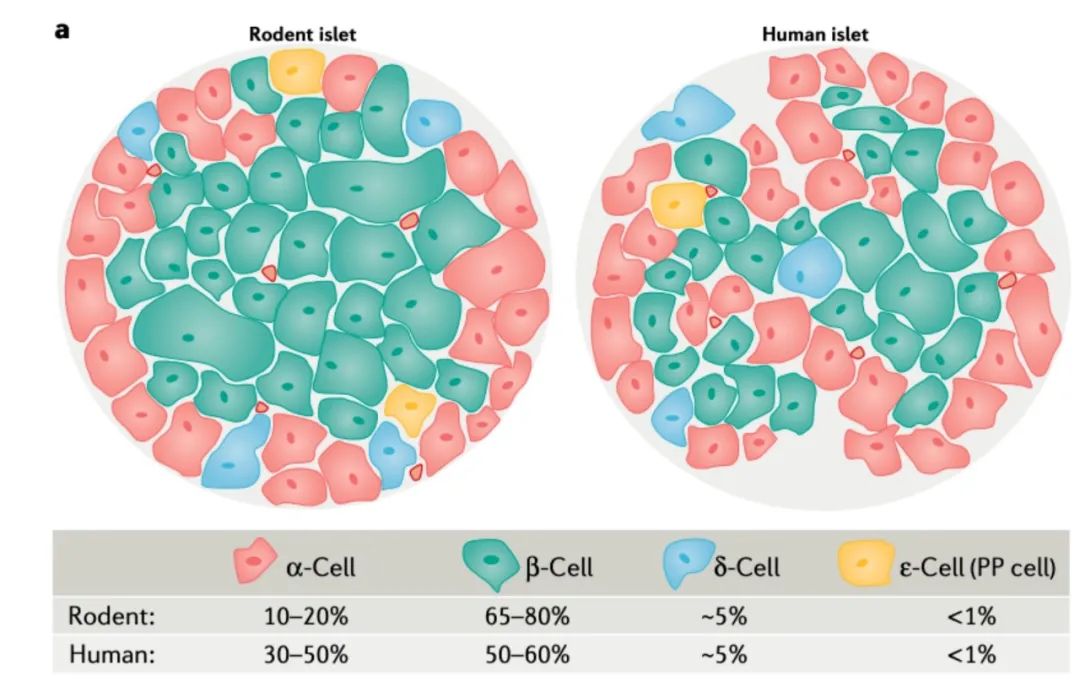
图 | 正常人和鼠胰岛构成
source:NatureReviewsMolecularCellBiology volume 22, pages142–158 (2021)
四、适用人群
理论上,只要使用外源胰岛素的糖尿病人都可以使用再生胰岛移植,这包括全部的I型糖尿病人和相当一部分II型糖尿病人。
在不远的未来,每个新患I型糖尿病的青少年,在使用再生胰岛后,终生无需使用外源胰岛素,也不必受到各种并发症的影响,生活质量将和健康人无异。
五、挑战
诚然,虽然前景令人向往,再生胰岛产业化仍然面临一些挑战。
(1)安全性,干细胞体内的长期安全性需要在临床上验证;
(2)免疫原性,I型糖尿病人会对胰岛细胞产生排斥,同时将来通用型胰岛也会面临同种异体排斥,在部分人群上可以使用免疫抑制剂或个体化来解决,更多的人群可能需要基因修饰的胰岛来解决;
(3)实现大规模生产,再生胰岛本质上是一种小型器官,是多种细胞的组织,大规模生产的难度也是远远超过当前的细胞药物;
(4)国家政策,目前国内对于糖尿病的再生治疗还没有清晰的政策。
参考文献:
Diabetes Care 2019;42:1593–1603 | https://doi.org/10.2337/dci19-0028
CDC. National Diabetes Statistics Report, 2020
Global trends in diabetes complications: a review of current evidence
Association of Time in Range, as Assessed by Continuous Glucose Monitoring, With Diabetic Retinopathy in Type 2 Diabetes. Diabetes Care 2018;41:2370–2376
N Engl J Med 2016;375:1834-44.DOI: 10.1056/NEJMoa1607141
[Curr Opin Organ Transplant 2016, 21:377 – 385 ]
[Am J Transplant 2018;18: 1581–1582]
https://investors.vrtx.com/news-releases/news-release-details/vertex-announces-positive-day-90-data-first-patient-phase-12
World J Transplant 2019 August 26; 9(4): 81-93
Latres E, Finan DA, Greenstein JL, Kowalski A, Kieffer TJ. Navigating Two Roads to Glucose Normalization in Diabetes: Automated Insulin Delivery Devices and Cell Therapy. Cell Metab. 2019 Mar 5;29(3):545-563.
Pullen LC. Stem cell-derived pancreatic progenitor cells have now been transplanted into patients: report from IPITA 2018. Am J Transplant 2018;18: 1581–1582
END
