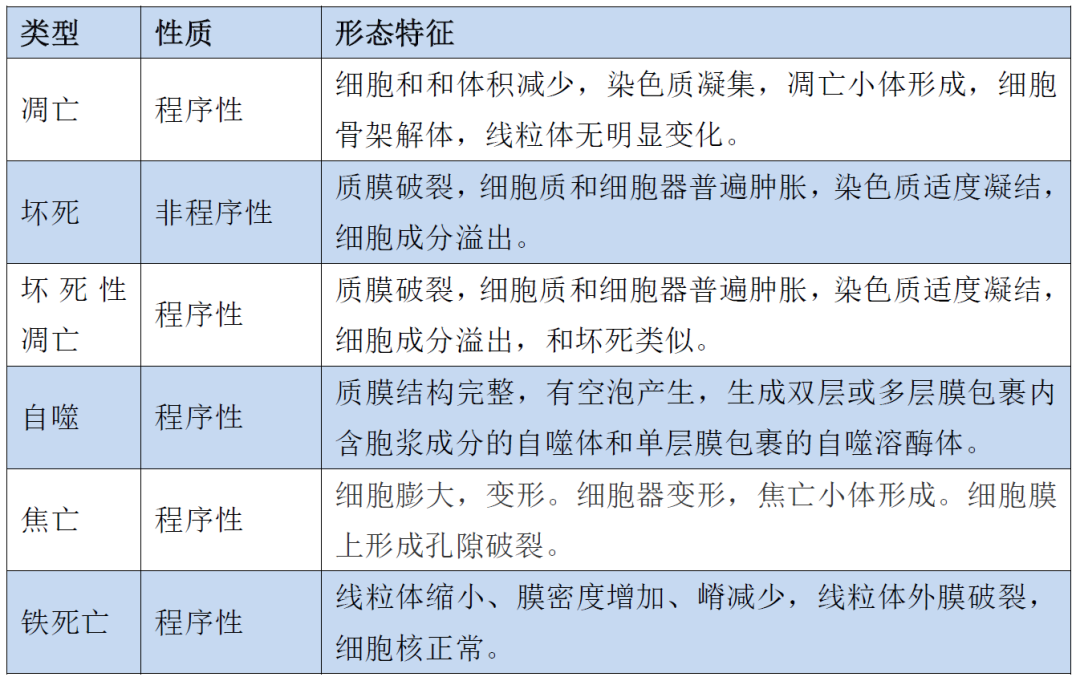
看电镜下细胞凋亡的形态学变化
以下文章来源于科享家 ,作者叶子
专注科研资源共享
生存还是死亡,我们身体中的细胞每天都在做着这样的选择——不仅选择是否死去,还选择了如何死去。当我们的认知还停留在它们的死亡只分凋亡和坏死两种方式的时候,它们的死法已经被发现了十几种,包括细胞凋亡(Apoptosis)、焦亡(Pyroptosis)、坏死性凋亡(Necroptosis)、铁死亡(Ferroptosis)、侵入性细胞死亡(Entosis)、PARP-1 依懒性程序性细胞死亡(Parthanatos)、溶酶体依赖性细胞死亡(Lysosome-dependent cell death ,LCD)、自噬(Autophagy)、坏死(Necrosis)以及NETosis、Alkaliptosis、Oxeiptosis等。这么多种死法,它们死去时是什么样子的呢?本篇内容就带领大家走进电镜的世界去认识几种较受关注的细胞死亡方式。

细胞凋亡
细胞凋亡(Apoptosis)是为维持内环境稳定的一种细胞自身主动的、生理性死亡机制,是通过细胞内基因及其产物的调控而发生的一种程序性细胞死亡。细胞凋亡涉及多步骤基因调控如Bcl-2家族蛋白及胱氨酸蛋白酶的激活,丝氨酸蛋白酶也可能参与其中。一般表现为单个细胞的死亡,且不伴有炎症的发生。
染色质逐渐凝聚成新月状附于核膜周边,嗜碱性增强。细胞核固缩呈均一的致密物,进而断裂为大小不一的片段;
胞膜不断出芽、脱落,细胞变成数个大小不等的由胞膜包裹的凋亡小体。凋亡小体内可含细胞浆、细胞器和核碎片,有的不含核碎片;
凋亡小体被具有吞噬功能的细胞如巨噬细胞、上皮细胞等吞噬、降解。
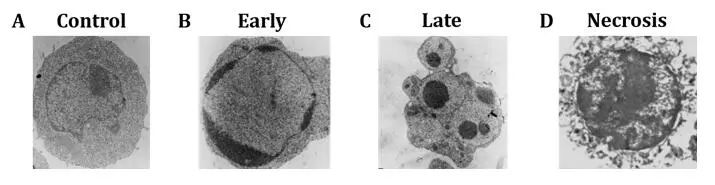
图1 电镜下细胞凋亡形态变化[1]

坏 死
坏死(Necrosis),与凋亡不同,通常被认为是一种非程序化的、被动的、非正常的细胞死亡过程。其特征是细胞肿胀、生物膜完整性丧失、细胞内容物溢出和离子梯度的消散,从而引发炎症反应。缺氧、冷冻或灼烧、病原体刺激、物理化学应激、缺血再灌注和钙超载等来自细胞外部的过度刺激,均可能会诱导细胞发生坏死。当凋亡细胞没有被吞噬时,也可能导致坏死,这一过程称为继发性坏死(此过程由特定的生化途径控制)。
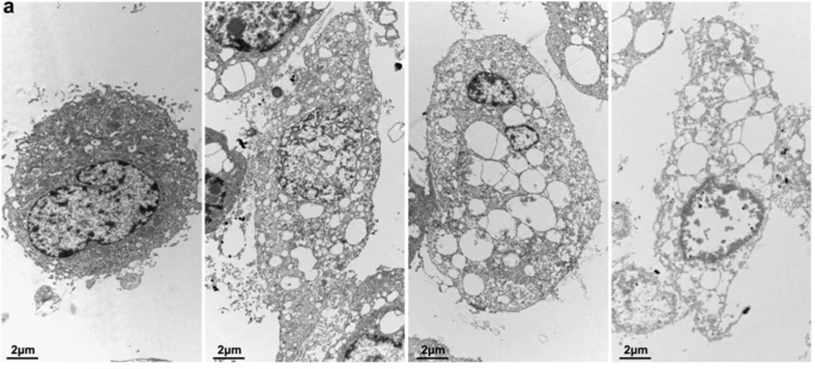
图2 OVCAR3细胞系的透射电镜图[2]
图中左1为正常细胞,其余为不同程度的坏死细胞

坏死性凋亡
坏死性凋亡(Necroptosis)是指当正常凋亡途径被抑制时,发生的一种受调控的由RIP1和RIP3激酶介导的坏死性细胞死亡方式,又叫程序性坏死。既以坏死的形态为特征,如细胞肿胀和破裂,又与细胞凋亡类似,由确定的信号通路控制。与坏死不同的是,坏死性凋亡有明确的细胞信号转导机制,而坏死没有。
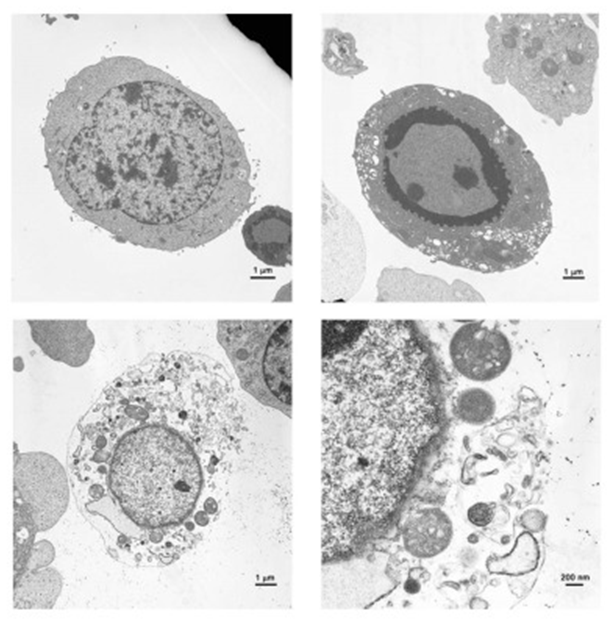
图3 HEI-OC1细胞系透射电镜图[3]
左上图为对照细胞,正常细胞器和细胞核。右上图为凋亡细胞,胞质浓缩、染色质边缘化和核碎裂。下图为坏死性凋亡细胞,质膜破裂、细胞质半透明、细胞器膨胀和核膜保留(左下:5000 倍,右下:20,000倍)。

自 噬
自噬(Autophagy)是细胞自身的物质结构进入细胞内由双膜包裹的大泡,并被降解消化的过程。此时形成的大泡称为自噬泡。自噬泡与溶酶体融合形成自噬溶酶体,广泛存在于正常的细胞内,在细胞内起"清道夫"作用。当组织细胞受到各种理化因素伤害时,大量增加,对细胞的损伤起到一种保护作用。自噬性溶酶体由单层膜包围,内部常含有尚未分解的内质网、线粒体和高尔基复合体或脂类、糖原等。
自噬经历吞噬泡到自噬体再到自噬溶酶体的过程。
新月状或杯状,双层或多层膜,有包绕胞浆成分的趋势。
双层或多层膜的液泡状结构,内含胞浆成分,如线粒体、内质网、核糖体等。
单层膜,胞浆成分已降解。
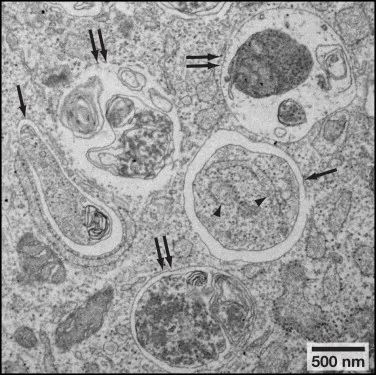
图4小鼠胚胎成纤维细胞透射电镜图[4]。
图中单箭头表示自噬体,双箭头表示自溶酶体

细胞焦亡
细胞焦亡(Pyroptosis)又称细胞炎性坏死,是一种新发现的细胞程序性死亡方式,主要通过炎症小体介导多种Caspase的激活,造成多种Gasdermin家族成员发生剪切和多聚化,造成细胞穿孔,进而引起细胞死亡。表现为细胞不断胀大直至细胞膜破裂,导致细胞内容物的释放进而激活强烈的炎症反应。细胞焦亡是机体重要的天然免疫反应,在拮抗感染和内源危险信号中发挥重要作用。相比于细胞凋亡,细胞焦亡发生的更快,并会伴随着大量促炎症因子的释放。
电镜下,可以清楚看到在细胞质膜破裂前,焦亡的细胞形成大量小泡,即焦亡小体。之后细胞膜上会形成孔隙,细胞膜破裂,内容物流出。
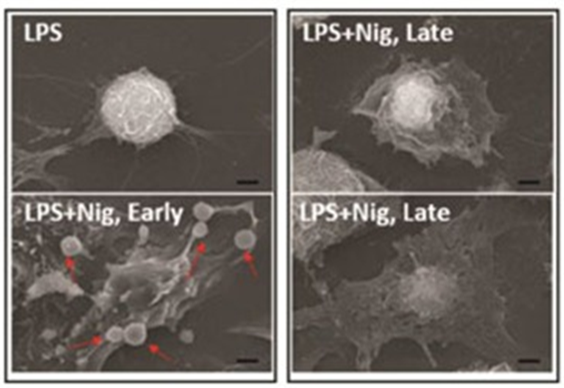
图5 RAW-asc 细胞扫描电镜图[5]
图中LPS为对照组,LPS + Nig组为焦亡细胞组,焦亡细胞早期细胞质变平,有气泡状细胞突起进展为与凋亡小体大小相似(LPS + Nig,Early组),焦亡细胞的晚期,细胞质变平,细胞核位于细胞体的中心,形状类似煎鸡蛋(LPS + Nig,Late组)。

铁死亡
铁死亡(Ferroptosis)是一种铁依赖性的新型细胞程序性死亡方式。主要机制为在二价铁或酯氧合酶的作用下,细胞膜上高表达的不饱和脂肪酸发生脂质过氧化而诱导的细胞死亡,抗氧化体系(谷胱甘肽系统)核心调控酶GPX4会降低。在形态学、生物化学和遗传学等方面与凋亡、坏死和自噬有较大差别。
细胞膜断裂和出泡,线粒体变小、膜密度增高、线粒体脊减少或消失、线粒体外膜断裂,细胞核大小正常、但缺乏染色质凝聚。
电镜下观察到细胞内线粒体变小及双层膜密度增高。
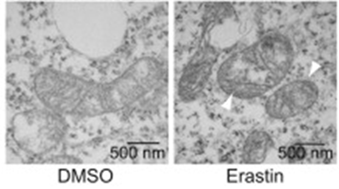
图6 BJeLR细胞系透射电镜图[6]
图中DMSO组为正常对照组;Erastin为铁死亡组,表现为线粒体体积变小,膜密度增高。

细胞不同死亡方式的区别
参考文献:
1. E. Bonanno, et al. Cell shape and organelle modification in apoptotic U937 cells. Eur. J. Histochem. 2000; 44: 237-246.
2.Liu L, et al. Berberine in combination with cisplatin induces necroptosis and apoptosis in ovarian cancer cells. Biol Res. 2019 Jul 18;52(1):37.
3. Kishino A, et al. Caspase-8 Regulates Endoplasmic Reticulum Stress-Induced Necroptosis Independent of the Apoptosis Pathway in Auditory Cells. Int J Mol Sci. 2019 Nov 24;20(23):5896.
4.Mizushima N, et al. Methods in mammalian autophagy research. Cell. 2010 Feb 5;140(3):313-26.
5.Xin C, et al. Pyroptosis is driven by non-selective gasdermin-D pore and its morphology is different from MLKL channel-mediated necroptosis. Cell Res. 2016 Sep;26(9):1007-20.
6.Dixon, S.J., et al., Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell, 2012. 149(5): p. 1060-72.
原标题:电镜下细胞不同的“死样”。
