PROTAC:新一代小分子药物潜在变革
以下文章来源于药闻窗 ,作者东风
在浩瀚星海的医药行业里,一起学习,进步和成长!


靶向蛋白质降解的嵌合体(PROTAC)是通过泛素-蛋白酶体系统(UPS)诱导靶向蛋白降解的一种全新技术,它代表了一种新的治疗方式并且成为关注焦点。与传统的抑制剂相比,在剂量、副作用、耐药性以及调节“非成药”靶标方面具有潜在的优势。
人类蛋白质组包含大约20,000种蛋白质,约80%被认为是“undruggable”的不可成药靶点。估计仅有10%的蛋白能用小分子调控,10%能用生物大分子调控的蛋白在细胞表面。
同时,已成药靶点易产生耐药突变,如EGFR-TKI等多种激酶抑制剂。
小分子降解剂的发展,尤其是蛋白降解靶向嵌合体(PROTACs),使得靶向不可成药的蛋白靶点或耐药突变靶点成为可能。靶向蛋白降解最有吸引力的地方在于它可以针对那些传统上认为不可成药的蛋白靶点,由于靶向蛋白降解策略可以通过结合蛋白上的几乎任何一个位点,而不是活性位点,来达到选择性的降解蛋白的目的,因此理论上这个策略可以用于任何一个蛋白质。此外,该策略的另一个优势是可以对那些已经产生抗药性的肿瘤发挥作用。

蛋白降解的历史可以追溯到1992年,研究发现氟维司群可降解ER。2001年,PROTAC技术概念被首次提出。至今,蛋白降解剂的研发探索已有20年的历史。
PROTAC与分子胶技术不断取得关键突破。一批专注于开发蛋白降解剂的biotech公司,Nurix Therapeutics、 Arvinas、Kymera Therapeutics、C4 Therapeutics相继成立,推动多款蛋白降解剂进入临床研究并获得初步积极数据。
图1 蛋白降解技术发展里程碑


真核细胞进化出动态和自我调节的“内控”机制,以适应新的环境条件和防止长期损害。细胞为维持内环境稳态,实现精细调控,需要将新陈代谢等生理过程以及应激等病理过程中产生的“异物”清除。真核细胞中负责蛋白质和细胞器降解的两大系统:泛素-蛋白酶体系统,自噬-溶酶体系统。
PROTAC(Proteolysis Targeting Chimera,蛋白靶向降解嵌合体)是通过泛素-蛋白酶体系统诱导靶向蛋白降解的一种全新技术。PROTACs分子的一端与靶蛋白结合,另一端与E3泛素连接酶结合。而E3泛素连接酶可通过将一种叫做泛素的小蛋白连接在靶蛋白上将其标记为缺陷或受损蛋白。之后,细胞的蛋白酶体会降解掉被标记的靶蛋白。因此,PROTAC分子能够将E3泛素连接酶募集到靶点蛋白附近,为靶点蛋白“贴上”泛素“标签”。而在细胞中,打上泛素“标签”的蛋白将被送入蛋白酶体进行降解。这样,PROTAC分子就能够特异性地促进致病蛋白的降解。
图2 PROTAC介导目标蛋白降解的机制

Arvinas开发的全球首个PROTAC药物ARV-110,拟用于治疗去势抵抗性前列腺癌,已经进入临床I期研究阶段,临床I期的初始数据表明ARV-110具有良好的口服利用度和良好的安全性和耐受性。
国际上也有十余个蛋白降解剂进入临床阶段,聚焦肿瘤治疗。
表1 PROTAC研究进展
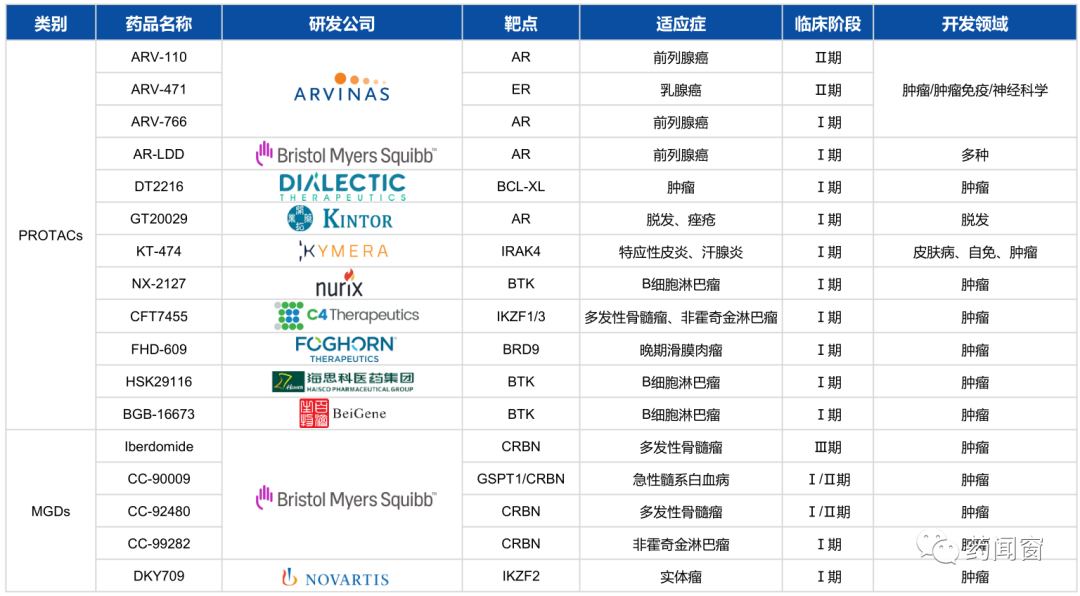

国际巨头也纷纷布局PROTAC技术领域,至今已达成十余项的重磅交易。
表2 PROTAC技术已达成多项重磅交易


国内企业也纷纷布局PROTAC技术领域。进入临床阶段有海思科、开拓药业和百济神州。
表3 国内PROTAC技术进展


PROTACs具有以下四种优势:
1、靶向降解“不可成药靶点”如KRAS、STAT3等;
2、克服肿瘤耐药性;
3、组织特异性靶向;
4、穿越血脑屏障。
具体来看,主要体现在以下几点:

PROTAC发挥作用不同于传统小分子药物需与靶蛋白紧密结合(占位驱动),主要取决于E3连接酶和靶蛋白的相互靠近(事件驱动)。
传统抑制剂的“占位驱动”:通常靶蛋白需要有合适的“活性口袋”,适合容纳小分子的明确活性位点。小分子抑制剂需持续占据蛋白的活性位点以阻断其功能,属于“占位驱动”。而在已被解析的疾病相关蛋白中,有高达80%的蛋白无法用现有药物去靶向,表面相对平滑,没有明显“口袋”——小分子抓不牢。药物剂量需要足够高使靶点饱和;半衰期足够长能持续抑制;亲和力够高能竞争过底物。
PROTAC只是提供结合活性,触发靶蛋白与E3连接酶结合从而引发降解这一事件,属于“事件驱动”。药物无需直接抑制目标蛋白的功能活性,也不需要与目标蛋白长时间和高强度的结合。利用PROTAC技术,理论上只要靶蛋白上有裂缝、缺口等可以提供短暂“着力点”。并且,PROTAC引发靶蛋白降解后即可从复合物中解离,并进入下一个催化循环,药物作用效率高。
图3 PROTACs与传统小分子药物作用机制对比


耐药突变在肿瘤治疗中一直是尚未突破的领域,例如BCR-ABL融合蛋白可诱发慢性粒细胞白血病和部分急性淋巴细胞白血病,临床用药是以伊马替尼为代表的多靶点TKI。随着耐药突变的产生,伊马替尼(一代)和达沙替尼(二代)针对T315I突变体几乎无抑制活性,三代药物泊那替尼仍存在严重的毒副作用;BTK的C481突变导致共价抑制剂伊布替尼疗效骤降。
PROTAC药物可有效降解突变型的BCR-ABL,对T315I突变的肿瘤细胞具有较高的抑制活性。理论上讲,突变型可用同一个PROTAC分子降解,对该靶点后续可能产生的耐药突变也有治疗作用,从而有潜力解决由于靶蛋白突变引起的临床患者耐药问题。
图4 PROTAC分子对BCR-ABL耐药突变肿瘤细胞具有良好抑制作用


PROTAC发挥功能除了与靶蛋白结合之外,还需要使靶蛋白与E3连接酶保持稳定的空间构象才能完成泛素化反应,这相当于对蛋白选择性进一步筛选。例如,多激酶抑制剂Foretinib,在竞争性结合实验中对100余种激酶具有较强的抑制活性(选择性差),而基于Foretinib设计的PROTAC分子可以结合54种激酶(选择性有所提高),但最终只能降解<15种激酶(选择性大幅提高)。
PROTAC在某些靶点上有潜力实现较高的选择性,从而避免“off target”带来的毒副作用。
图5 PROTAC分子选择性显著高于对应激酶抑制剂


PROTAC引发靶蛋白降解后即可从复合物中解离,并进入下一个催化循环,药物作用效率高,可快速将细胞内靶蛋白降解。并且,细胞内蛋白质合成速度较为缓慢,即便经过代谢后PROTAC在体内清除,细胞仍需要较长时间将靶蛋白恢复至发挥生理作用的水平,从而有望延长药物作用时间。
因此,PROTAC有望在低用药剂量,低给药频次下实现持久的疗效。这一潜力在临床前研究中已得到初步证实:一款靶向RIPK2的PROTAC降解剂,动物给药168h后,体内血药浓度已降到10ng/ml以下,而此时体内RIPK2蛋白仍然可以维持较低含量,致炎因子TNFα也维持在较高的抑制水平。
图6 PROTAC的蛋白降解作用可在给药后维持较长时间
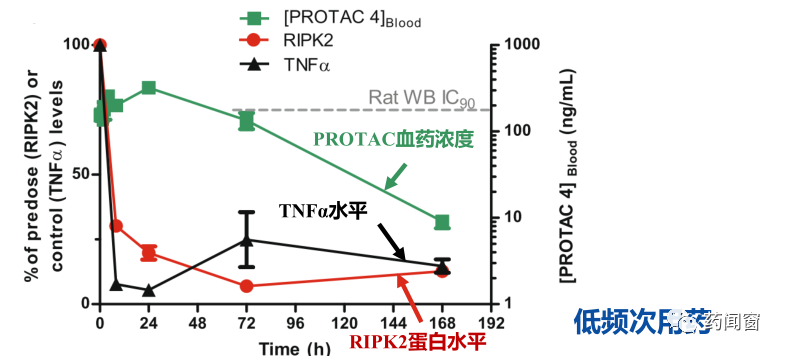
图7 PROTAC催化效应可提高药物作用效率


PROTAC技术优势全面。相较于传统小分子抑制剂,PROTAC可对非酶蛋白、Undruggable蛋白等进行降解;活性和选择性有望更高;并且具有催化效应,有望实现低剂量、低频次用药。
表4 PROTAC技术优势


相较于单抗,PROTAC可靶向大量细胞内靶标,组织渗透性更强,可实现口服用药。
siRNA和PROTAC均可实现蛋白降解,但siRNA半衰期短、易降解,药物递送仍然是限制其应用的重要因素。
PROTAC技术在靶向Undruggable蛋白、克服耐药、选择性、用药途径等方面优势全面,开发潜力大,应用前景广阔。

总之,PROTAC作为新一代成药技术已经逐渐完成了概念验证,部分产品在临床I/II期中取得了积极结果,有望克服现有产品耐药或者突破不可成药的靶点。

