SWOT分析:靶向蛋白降解药物开发的冰与火!
以下文章来源于BiG生物创新社 ,作者BiG专栏
BiG, Biologics Innovation Group. To nurture an Eco-system for Biologics innovation and imprint China on Global map.
SWOT(Strengths-Weaknesses-Opportunities-Threats)分析通常被用于商业发展和战略规划,也可以尝试用于批判性评估迅速发展的领域,比如丹娜法伯癌症研究院(Dana-Farber Cancer Institute)将其用于靶向蛋白降解(targeted protein degradation,TPD)。

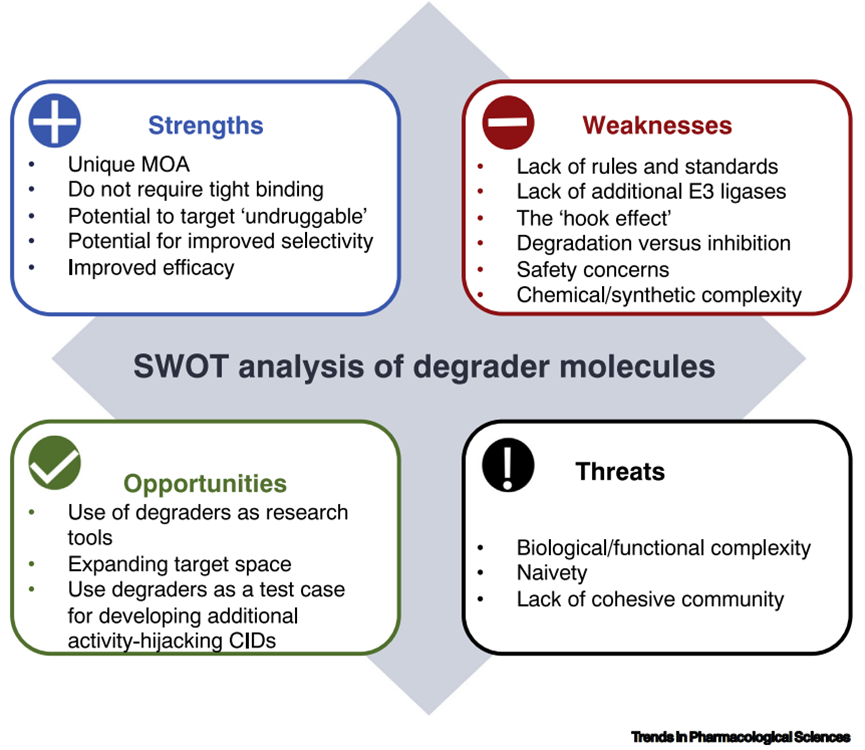
优势(Strengths)
靶向蛋白降解可以直接“敲除”POI( protein of interest)的能力。这些蛋白敲除相对快速和可逆,与CRISPR/Cas9等遗传策略相补充。
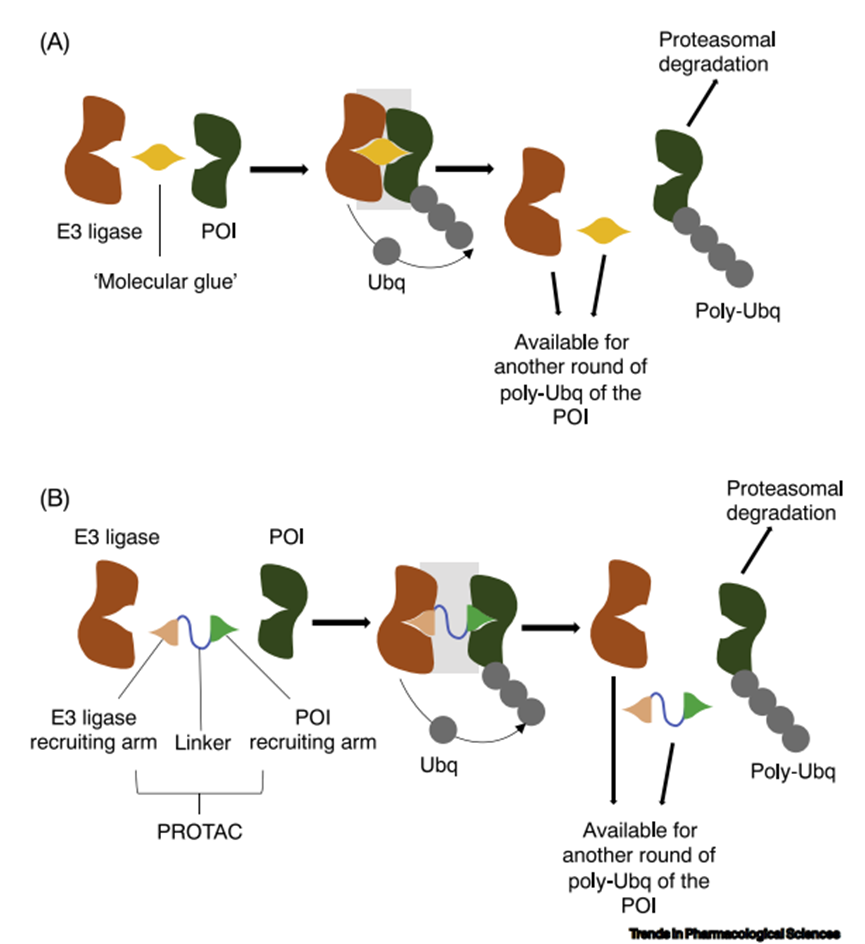
TPD分子不需要紧密结合来发挥其作用,对缺乏明确的小分子结合袋的POI,也可能是可行的,为“不可用药”的POI提供机会。TPD分子不需要抑制POI功能,它们只需要结合靶点即可。
TPD分子通常比抑制剂具有更好的选择性,因为TPD依赖于降解分子、POI和E3连接酶形成复合物,减少非复合物降解分子的非特异性作用。
TPD很可能会更有效。虽然基于PROTAC在临床环境中的疗效尚未得到证实,但临床前研究表明,这些分子可以在较低浓度和较长时间内发挥作用。由于降解消除了整个POI,因此预计其影响将更加深刻和持久,对于除了酶活性外,还发挥骨架或其他作用的多功能蛋白质尤其重要。

劣势(Weakness)
PROTACs最常被提到的缺点之一是它们不符合Lipinski的“5规则”(Ro5)。临床试验中的PROTACs是口服生物可利用性的,需要制定新的剂型来支持。目前缺乏明确的设计规则和原则,该领域在很大程度上仍然是经验为主。
对于没有已知支架功能的靶点,还不能预测降解策略是否会提供比抑制具有更好的疗效优势。很难预测哪一种E3连接酶将产生性能更好的PROTAC分子,因此,可能需要开发和表征几个不同系列解决这个问题
尽管人类基因组编码大约600个E3连接酶(不是都介导泛素化),目前可用于PROTAC介导靶向的E3连接酶种类较少,集中在CRBN和VHL,需要进一步研究扩大E3连接酶池。
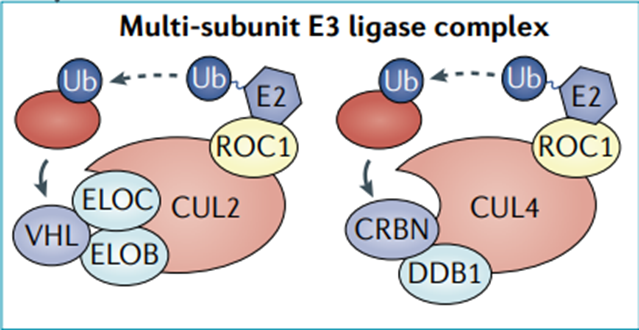
NatRev Cancer . 2021 Oct;21(10):638-654
PROTACs活性的也呈典型的钟形浓度依赖性(“钩效应/Hook effect”)。在高浓度下,PROTAC分子可以饱和POI或E3连接酶上的结合位点,而不形成所需的三元复合物。这导致活性降低和抑制诱导降解。
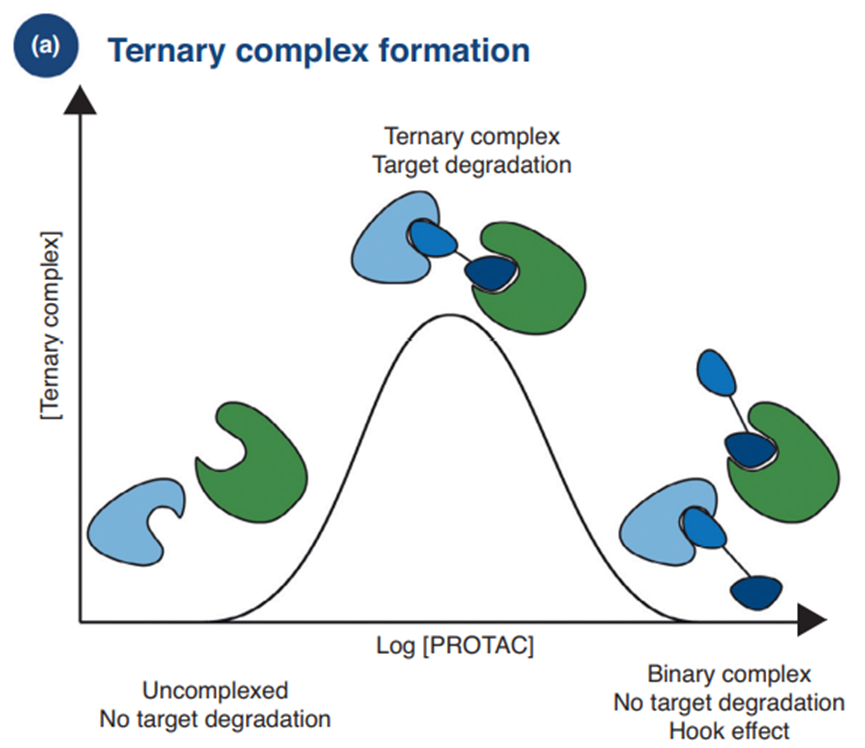
Hookeffect (Drug Discov. Today Technol. 2019. 31, 15–27)
目前缺乏靶向降解药物验证标准和指南。对于使用抑制剂作为POI招募臂的PROTACs,重要的是要排除内在抑制活性的作用,以确定观察到的表型是由预期靶点的降解驱动的。
很多蛋白质具有生理功能,去除整个蛋白质也可能带来毒性,并且可能难以预测。
较大化合物的合成复杂性。减慢了开发速度并增加了成本,因为每个合成步骤都需要优化,而每个中间体通常都需要纯化。
机会(Opportunities)
小分子降解剂,包括“分子胶”和PROTACs,正在成为蛋白质组的强大的研究工具。作为蛋白质敲除试剂,在遗传策略无法获得结果的情况下,TPD选择性去除POI(通常可达30分钟到数小时)。它们还提供了一个容易评估剂量依赖性的机会,这可以促进靶点验证研究。
目前PROTACs主要药物靶点是激素受体、激酶和溴结构域PROTACs,分子胶主要靶向转录因子,未来与药理相关的可降解蛋白质组都有可能成为新靶点。
化学诱导二聚化(chemically induced dimerizers,CID),是通过化合物诱导两个蛋白质形成二聚体嵌合体,行使不同的功能。TPD是一种特殊的CID,基于此,可以将招募泛素连接酶的小分子,变换为招募磷酸化酶的小分子,实现对于POI的磷酸化,从而实现蛋白质的特定翻译后修饰。
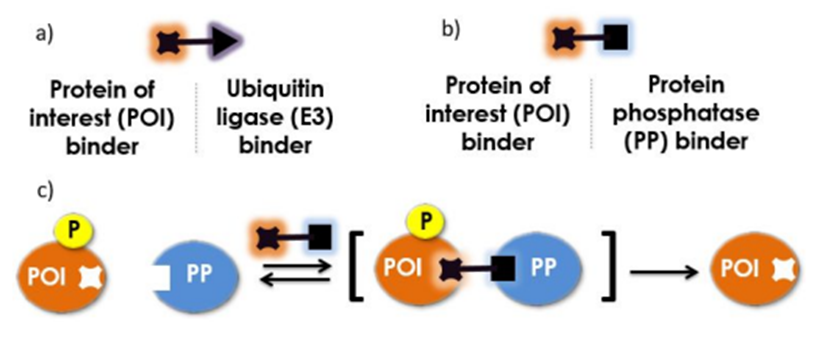
POI磷酸化(J Med Chem 2020 Mar26;63(6):2807-2813.)

威胁(Threats)
对泛素-蛋白酶体系统,降解分子功能等,我们生物学知识体系还不完整。目前,大多数的靶向降解研究都集中在如何尽快进入临床上,对于基础研究,如泛素连接酶的新底物,被降解蛋白的分布及生理功能,TPD使用之后表观遗传学的变化,耐药机制等,都研究的不深入。
在RNAi药物研发早期,人们也认为它无所不能,可以实现所有药靶的成药性,但是事实并非如此。TPD同样,人们开始将其作为无法成药靶点的救命稻草,但是临床的进展也不像大家期望的那么迅速,最终,我们可能发现只是适合个别靶点。
总 结
丹娜法伯癌症研究院将商业领域内的SWOT分析,应用于靶向蛋白降解药物开发,帮助我们清晰的了解这个方法的优势,弱点,机会与威胁。在PROTACs高歌猛进的时候,可以有一个清醒的认识。
主要参考文献
1.Beveridge, R. et al. Nativemass spectrometry can effectively predict PROTAC efficacy. bioRxiv Publishedonline November 25, 2019. https://doi.org/10.1101/851980
2.Brandon Dale et al,Advancing targeted protein degradation for cancer therapy,Nat Rev Cancer . 2021 Oct;21(10):638-654
3.Pettersson, M. and Crews, C.M. PROteolysisTArgeting Chimeras (PROTACs)—past, present and future. Drug Discov. TodayTechnol. 2019. 31, 15–27
4.Yamazoe, S. et al.Heterobifunctional molecules induce dephosphorylation of kinases–a proof ofconcept study. J Med Chem. 2020 Mar 26;63(6):2807-2813.
5.Milka Kostic et al,CriticalAssessment of Targeted Protein Degradation as a Research Tool andPharmacological Modality, Trends Pharmacol Sci . 2020 May;41(5):305-317.
— THE END —
