复发/难治性急性髓系白血病治疗取得突破!全球首创IO-202抑制剂获FDA快速通道资格认定|北极光·Family

Immune-Onc Therapeutics, Inc.(简称“以明生物”)今日宣布,美国食品药品监督管理局(FDA)授予IO-202治疗复发或难治性急性髓系白血病(AML)快速通道资格。IO-202是一款靶向白细胞免疫球蛋白样受体B4(LILRB4,又称ILT3)的首创抗体新药,已于2020年10月获得FDA孤儿药资格认定,用于治疗急性髓系白血病(AML)。

以明生物首席医学官Paul Woodard博士表示:“我们很高兴FDA肯定IO-202对复发或难治性急性髓系白血病患者的治疗潜力,授予我们快速通道资格。以明生物期待继续与FDA密切配合,加快IO-202单药或与其他药物联合治疗单核细胞分化急性髓系白血病(AML)和慢性粒-单核细胞白血病(CMML)的剂量递增和剂量扩展I期临床研究。”
FDA快速通道资格认定(Fast Track Designation)旨在通过加快审评促进治疗重大疾病的药物开发,帮助患者早日用上新药,解决未满足的临床需求。获得快速通道资格认定意味着有机会与FDA进行更频繁的互动和书面交流,讨论药物研发计划和数据收集以助力药物获批。如果相关标准符合要求,该资格认定将有助于获得加速批准和优先审评资格。
以明生物是一家处于临床研发阶段的生物制药公司,专注于癌症免疫治疗,致力于为癌症患者研发全新的髓系细胞免疫检查点抑制剂。公司的目标是通过转化对髓系细胞生物学和免疫抑制性受体独到的科学见解,发现并开发可以在肿瘤微环境中解除免疫抑制的首创生物新药。公司围绕髓系细胞免疫检查点——白细胞免疫球蛋白样受体亚家族B(LILRB),利用生物学平台的协同效应,已打造出多条极具潜力的产品管线。其中包括两款处于I期临床开发阶段的全球首创新药:除了靶向LILRB4(又称ILT3)的抑制性抗体IO-202于2020年进入临床外,针对实体瘤、靶向LILRB2(又称ILT4)的全新抑制性抗体IO-108于2021年进入临床。此外,公司产品管线还包括一款靶向LAIR1的首创抑制性抗体新药IO-106,以及多个未公开的针对实体瘤和恶性血液瘤的项目。
LILRB4(ILT3)和IO-202
LILRB4,又称ILT3,是髓系单核细胞(包括树突状细胞)表面的一种免疫抑制性跨膜蛋白。LILRB4可抑制抗原呈递细胞激活,导致免疫耐受。LILRB4在特定血液瘤细胞和实体瘤微环境中的髓系单核细胞表面也有表达。以明生物联合德克萨斯大学在《自然》杂志上发表了原创性研究1,阐明LILRB4在急性髓系白血病(AML)的免疫抑制和肿瘤浸润中的作用,并在美国癌症研究协会(AACR)2021年会上报告实体瘤中靶向LILRB4的治疗意义2。
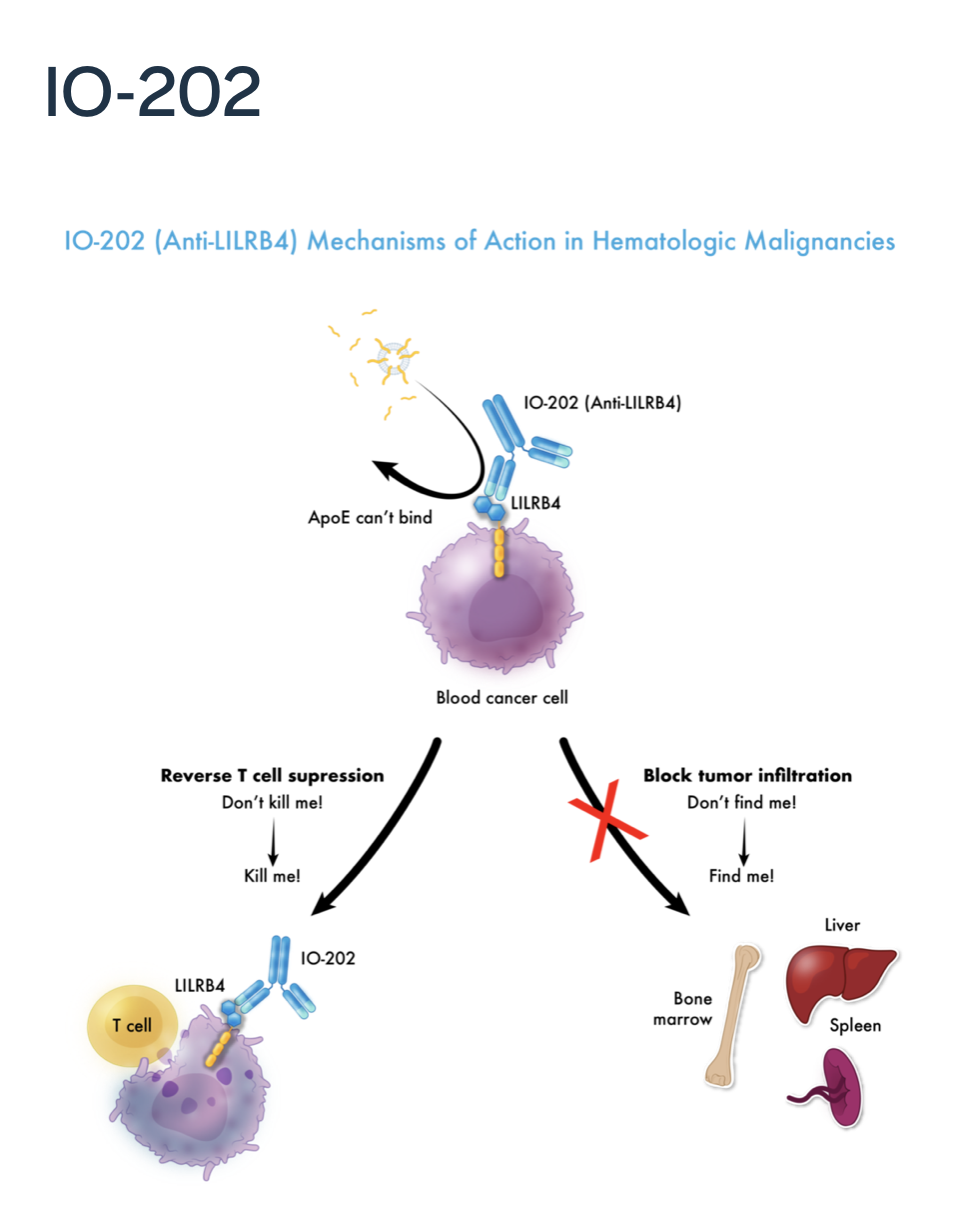
IO-202是全球首创靶向LILRB4的抑制性抗体,在血液瘤和实体瘤的免疫治疗方面具有广泛潜力。血液瘤的临床前研究表明,IO-202可激活T细胞杀伤作用将“别杀我”信号转换为“来杀我”信号,并通过抑制血液瘤细胞浸润将“看不到我”信号转换为“我在这里”信号。实体瘤的临床前数据表明,IO-202在体外研究中具有增强树突状细胞功能和T细胞激活作用,并能在实体瘤体内研究模型中抑制肿瘤生长。
目前,IO-202正处于针对急性髓系白血病(AML)和慢性粒-单核细胞白血病(CMML)适应症的I期临床开发阶段。2020年10月,IO-202获得美国FDA授予的孤儿药资格认定,用于治疗急性髓系白血病。2022年1月,IO-202实体瘤临床研究IND在美国获批。

相关新闻
Immune-Onc超募完成约7300万美元融资,开发首创抗肿瘤新药
LILRB2(ILT4)全新抑制性抗体IO-108在美国完成首例晚期实体瘤患者给药
