适配体药物偶联(ApDC)
以下文章来源于医药速览 ,作者墙缝里的dust
医药和生命科学领域最新研究热点,紧跟新靶点,新技术以及新药研发进展,不仅有最好玩的大众科普,也有专业医药领域的文献解读以及对不同生命科学领域的总结与梳理。
▉ 研究背景
目前大多数肿瘤药物策略是靶向治疗,但事实上很多药物的选择性较差,并且有一定的脱靶毒性。目前越来越流行的办法是使用特异性的配体来增加药物的选择性。
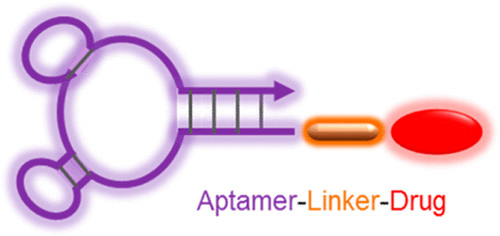
ApDC
(来源Bioconjugate Chem. 2015, 26, 11, 2186–2197)
抗体是一种主要的识别配体,在过去的几十年里广泛地应用于ADC的发展。与之类似,ApDC就是把其中的抗体(Antibody)换成适配体(Apdamer),连接子负责连接适配体与药物分子,药物则发挥疗效,而适配体作为识别配体,指导治疗药物靶向疾病部位或调节靶向生物标志物的生物学功能。
与抗体相比,适配体有很多优势:
1)适配体筛选效率高,只需要几天到几个月;
3)核酸的固相合成技术比较成熟,成本较低,而且批次差异很小;
4)适配体更容易修饰;
5)热稳定性和化学稳定性更好;
6)分子量更小,组织渗透性更好;
7)几乎没有免疫原性,不会产生免疫副作用。
适配体常常与多种疗法联用,如化疗、光疗、毒素、基因疗法、疫苗等。陈小元教授等人在Bioconjugate Chemistry上发表了一篇介绍ApDC的综述,下面带大家一起解读一下。
▉ 1. 适配体偶联化疗药
传统化疗药由于脱靶效应,具有很大的毒性,因此需要选择性地将化疗药物递送到肿瘤组织。适配体可以广泛地和各种化疗药物偶联,这得益于其化学稳定性,以及它成熟的合成技术和定点修饰技术。
适配体与化疗药物可通过共价键结合。例如DNA适配体sgc8与化疗药阿霉素(Dox)就是通过腙连接子进行连接(图1A),该连接子在酸性条件下就会分解,当进入内吞体或溶酶体后,即释放出Dox。
连接了适配体后,药物的选择性大大提高,但这种连接方式存在的问题是,一个适配体只能携带一个药物分子(拷贝数为1)。为解决这一问题,人们设计了一种亚磷酰胺结构的连接子(图1B),这种连接子可通过DNA固相合成嵌入到适配体sgc8中,然后在连接子与化疗药5-氟尿嘧啶之间加一个光敏连接子,由光敏连接子来控制药物的释放。这种连接方式将适配体的拷贝数提高到了5,并表现出较好的抗肿瘤作用。
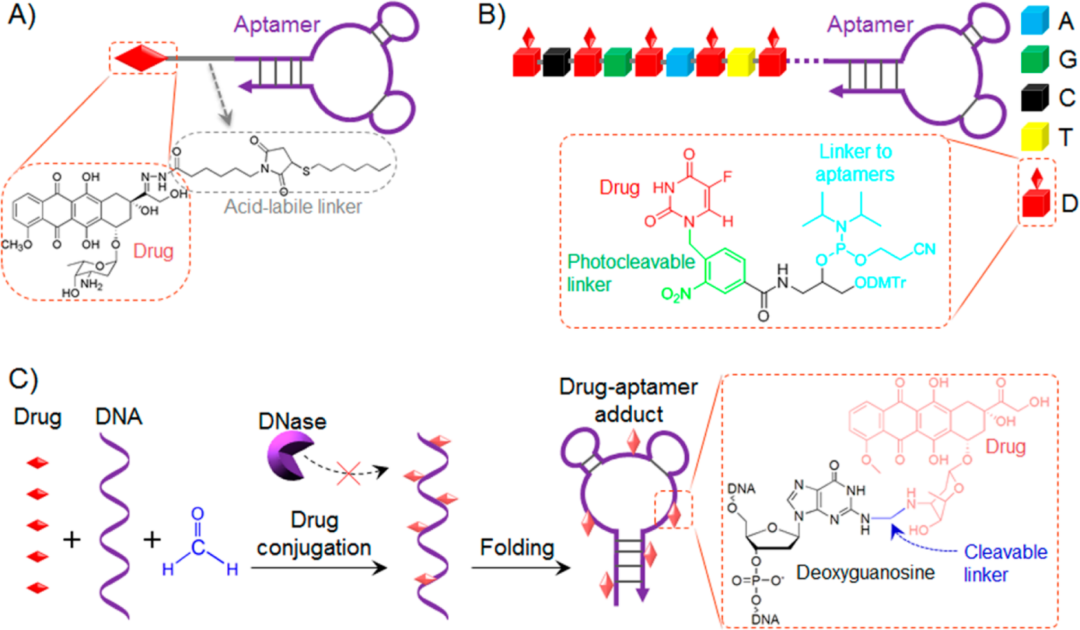
图1
(来源Bioconjugate Chem. 2015, 26, 11, 2186–2197)
以上两种方法都是在适配体的基础上连接药物分子,还有一种方法,就是在适配体成形之前就事先将药物分子与DNA链偶联,即先拿到DNA链,然后将其与药物Dox通过多聚甲醛进行交联,Dox的3-NH2与脱氧鸟苷(dG)的2-NH2之间形成一个亚甲基(图1C)。
这种ApDC可以在较低温度下就能合成出来,并且拷贝数也较高。但相对地也会产生一些问题,这种连接方式对温度敏感,在生理温度下就会缓慢释放药物分子,造成一定毒性。此外,它的拷贝数并不固定,不能保证每一个适配体都有很高的拷贝数。
除了共价连接,药物还可以通过非共价的方式连接到适配体。最典型的例子就是蒽环类药物可插入到dsDNA/dsRNA的GC碱基对中(图2A)。例如A10(一种靶向psma的RNA适配体)具有Dox固有的药物插层位点。在此基础之上,人们在适配体上插入一些具有重复GC碱基对的结构(图2B),从而增加载药量。
另一种方法是通过两个适配体共同组成这一结构(图2C),例如sgc8和sgd5a可特异识别不同亚型的癌症,组成双价核算适配体后,不仅加大载药量,还表现出双特异性。
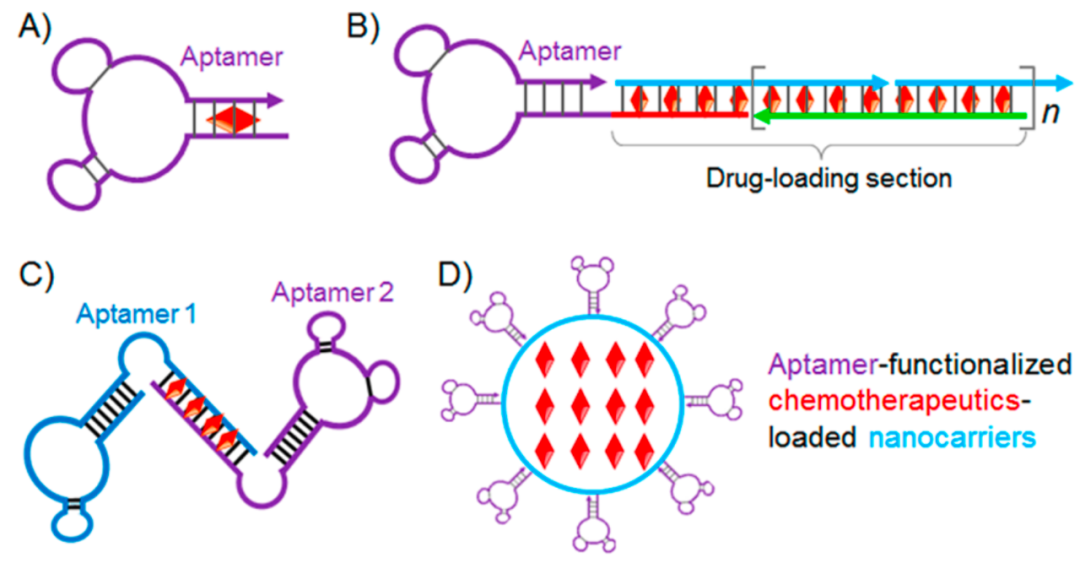
图2
适配体还能与纳米材料联用(图2D),前者保证了选择性,后者保证了载药量。载药纳米材料有很多,如脂质体、胶束、聚合物、dna、金、磁性纳米颗粒等,但研究最久的是聚乳酸-羟基乙酸(PLGA)纳米颗粒,通过将PLGA - PEG二嵌段和PLGA - PEG -适配体三嵌段聚合物进行纳米颗粒自组装,从而得到适配体修饰的纳米球。
▉ 2. 适配体偶联核酸
基于人类基因组和疾病基因组的不断完善,人们对基因疗法的研究不断深入,基于病毒的基因递送、RNA干扰、反义寡核苷酸、基因编辑等技术层出不穷,虽然这些技术已经取得很多成就,但在选择性上还有待改善,因此适配体有望成为选择性递送基因疗法的角色。
人们已经尝试将适配体与small interfering RNA(siRNA)、small hairpin RNA(shRNA)以及microRNA(miRNA)进行偶联,用于治疗癌症或一些自身免疫疾病。将A10(PSMA特异性适配体)与作用于Plk1和Bcl2的siRNA偶联,得到A10-Plk1和A10-Bcl2偶联物(图3A),可选择性进入过表达PSMA的LNCaP癌细胞,致使目的基因沉默,最终引发细胞凋亡,而对不表达PSMA的PC-3细胞,则不会导致其凋亡。
shRNA可以通过质粒转染或病毒基因的方式达到长久作用,也可以使用人为合成的方式进行递送治疗,后者就可以借助适配体的选择性,达到精准治疗的目的。例如,在前列腺癌放疗中,可用A10将DNAPK shRNA递送到PSMA阳性的癌细胞(图3B),特异性地增强了PSMA阳性肿瘤对放疗的反应。
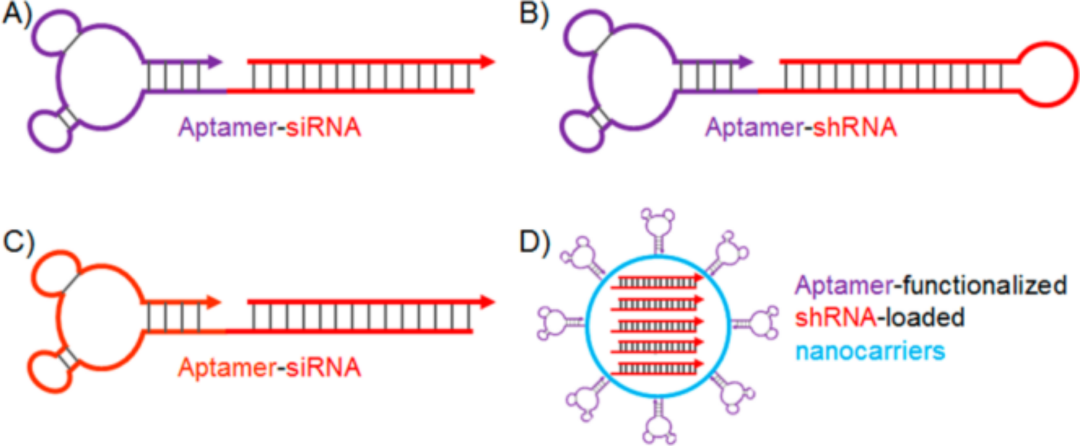
图3
与小分子化疗药类似,siRNA/shRNA也可用适配体修饰的纳米球进行包裹(图3D),大大增加载药量。例如用适配体CH6修饰过的脂质纳米球包裹Plekho1 siRNA,CH6特异性结合成骨细胞,Plekho1 siRNA诱导Plekho1沉默,促进骨形成,改善骨微结构,增加骨量。
▉ 3. 适配体偶联蛋白/多肽
蛋白质和多肽也可以作为药物进行治疗,但只有部分具有很好的选择性,如抗体药有靶向HER2的曲妥珠单抗和靶向EGFR的西妥昔单抗,多肽药有靶向GLP-1的exendin-4。还有很多蛋白质和多肽都没有选择性,因此将它们与适配体偶联可以很好地解决这一问题。
明胶(Gelonin)是一种糖苷酶,可以破坏核糖体RNA(rRNA)中的糖苷键,阻碍蛋白质合成,诱导细胞死亡。但它不能自己进入细胞,而将重组明胶(rGel)与适配体A10偶联后(图4A),就可以通过内化作用进入细胞,并且选择性地作用于PSMA阳性细胞。
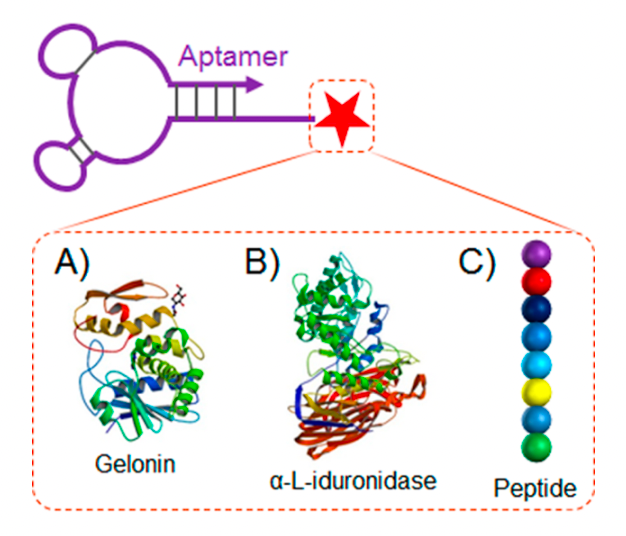
图4
溶酶体贮积症(LSD)是一组遗传性代谢疾病,是由于基因突变致溶酶体中有关酸性水解酶缺陷,导致机体中相应的生物大分子不能正常降解而在溶酶体中贮积,引起细胞组织器官功能的障碍。外源性α-L-iduronidase可以降解细胞中积聚的糖胺聚糖(GAG),将其与适配体GS24偶联后(图4B),通过特异性结合转铁蛋白受体(TrR),然后通过内化作用进入成纤维细胞,从而发挥作用。
▉4.适配体偶偶联光敏剂
光动力疗法(PDT)是一种新型无创疗法,它依靠特定波长光源照射激活肿瘤组织中的光敏剂产生具有生物毒性的单态氧等活性氧物质(Reactive oxygen species,ROS),从而对细胞产生杀伤作用。虽然可以通过控制光的照射范围来控制治疗部位,但仍需要事先将光敏剂输送到特定组织或器官,因此可以考虑借助适配体进行递送。
适配体TD05靶向于IgM μ重链(在B细胞瘤中过表达),与光敏剂Ce6偶联后(图5A),可选择性杀伤Ramos癌细胞。
AIR-3A是一种IL-6R适配体,将其与光敏剂Ce6偶联后,即可选择性地将Ce6内化到IL-6R阳性细胞中,比单独Ce6的效力大大增加,同时大大减少了对其他细胞的毒性。当然,除了Ce6,还有很多其他光敏剂,如5,10,15,20-tetrakis(1-methyl-4-pyridyl)-21H, 23H-porphine (TMPyP4)和porphyrin。
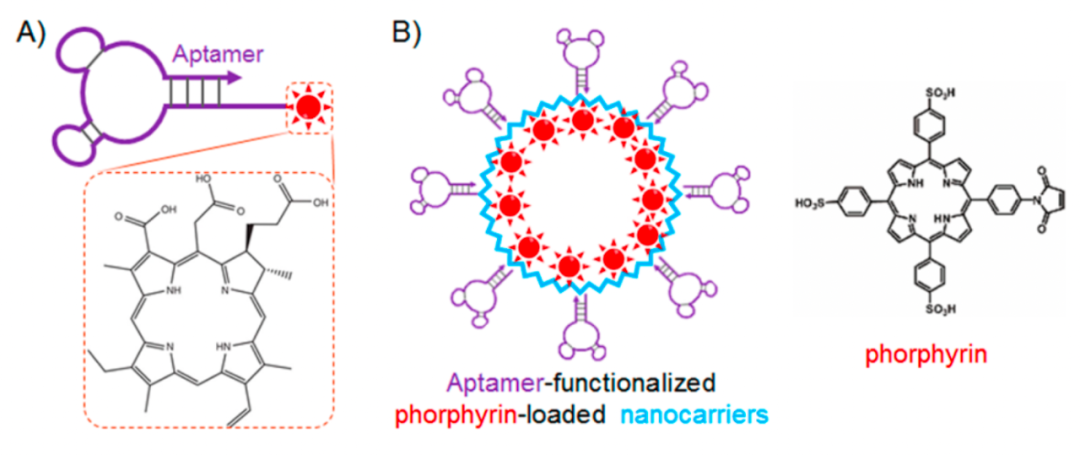
图5
(来源Bioconjugate Chem. 2015, 26, 11, 2186–2197)
同样的,光敏剂也可用纳米球包裹。人们对噬菌体MS2进行改造,得到一个直径27nm的球形病毒衣壳,该衣壳由180个相同的蛋白单体构成。然后在MS2的外表面修饰适配体sgc8(靶向PTK7),在内表面修饰卟啉,每个MS2可负载20个sgc8和180个卟啉(图5B)。这种纳米偶联药可应用于Jurkat白血病的选择性PDT。
以上提到的纳米材料都是用来包裹其他治疗分子,但事实上,纳米材料本身也可作为治疗分子,常被用于光热疗法(PTT),当纳米材料受到特定波长电磁照射后,即可放热,从而杀伤细胞。光热纳米材料有金纳米材料(纳米棒、纳米壳、纳米笼、纳米颗粒、纳米复合物)、含有多个多巴胺的纳米材料、碳纳米材料(纳米石墨烯、纳米石墨烯氧化物、碳纳米管)、杂化纳米复合物(金-石墨烯氧化物复合物)。将这些材料与适配体偶联后,就可以达到靶向治疗的目的。
金纳米棒(AuNR)在近红外下具有很高的热效应,与sgc8偶联后,即可选择性地作用于CEM细胞。事实上,AuNR在近红外照射下还会产生很强的表面等离子体吸收,可作为一种能量淬灭剂,于是人们想到将其与光敏剂Ce6联用,设计了一种类似开关的结构ASP(aptamer switch probes)。
ASP是将适配体的一端偶联到AuNR表面,另一端偶联Ce6,在到达靶细胞之前,Ce6靠近AuNR表面,因而Ce6释放出的能量正好被AuNR吸收,而当适配体到达靶点后,其构象发生改变,导致Ce6远离AuNR,能量无法转换,于是就产生ROS,产生细胞毒作用。
▉ 总结
尽管适配体相比抗体有很多优势,但它也存在一些问题。
1)SELEX技术生成的适配体可以有很高的亲和力,但不一定有生物活性;
2)核酸适配体容易被核酸酶降解。
针对第一个问题,一般都会将适配体与其他治疗方法联用,制备成各种适配体偶联物。
针对第二个问题,可以对核酸进行化学修饰,也可以用如纳米材料等结构对核酸进行保护。
参考文献:
Zhu G, Niu G, Chen X. Aptamer-Drug Conjugates. Bioconjug Chem. 2015 Nov 18;26(11):2186-97.
编辑人:宁帅同学
转载内容仅代表作者观点
不代表国家纳米中心立场
